کاربرد عنصر پولونیم چیست؟ خواص پلونیوم را می شناسید؟

عنصر پولونیم از عناصر شیمیایی جدول تناوبی مندلیف بوده و با نماد شیمیایی Po شناخته می شود. عدد اتمی عنصر پولونیم ۸۴ و عدد جرمی آن ۲۰۹ است. خواص عنصر پولونیم موجب شده است تا در گروه ۱۶ و تناوب ۶ قرار گیرد. از خواص عنصر پولونیم این است که عنصری به شدت رادیواکتیو و بدون ایزوتوپ پایدار است. امروزه تولید عنصر پولونیم با فعال سازی نوترونی بیسموت صورت می پذیرد. جالب است بدانید عنصر پولونیم توسط ماری و پیر کوری کشف شد. کاربرد عنصر پولونیم نیز به خواص رادیو اکتیو آن بر می گردد. در کل کاربرد های کمی برای عنصر پلونیوم معرفی شده است. عنصر پولونیم به دو شکل فلزی یعنی فرم آلفا و بتا وجود دارد. ایزوتوپ عنصر پولونیم در تعداد زیاد وجود داشته که همه آن ها نیز رادیو اکتیو هستند. در ادامه با ما همراه باشید.
نشریه علمی جهان شیمی فیزیک به بررسی عناصر شیمیایی جدول تناوبی مندلیف پرداخته است. عناصری مانند: اکسیژن، گوگرد، سلنیوم، تلوریم و… مورد بررسی قرار گرفته اند. در ادامه با شناخت و معرفی عنصر پولونیم از عناصر شیمیایی جدول تناوبی با ما همراه باشید.
تاریخچه عنصر پولونیم
در سال ۱۸۹۸ عنصر پولونیم توسط ماری و پیر کوری کشف شد. نام این عنصر نیز از نام سرزمین مادری ماری کوری (پولند) گرفته شده است. ماری کوری عنصر پولونیم را از اورانیت استخراج کرد. اورانیت همان کانی اورانیم است. اورانیت از اورانیمی که از آن استخراج می شد، رادیواکتیو تر بود. وی از این مشاهده نتیجه گرفت که اورانیت باید حداقل یک عنصر رادیواکتیو دیگر را شامل باشد. چند تن کانی اورانیت برای به دست آوردن تنها ۰٫۰۰۰۱ گرم پلونیوم لازم است.

ماری و پیر تحقیقات خود را روی کشف عنصری در ماده ای معدنی متمرکز کردند. اما این دو تا پایان سال ۱۸۹۸ پس از تحقیق روی این ماده دو عنصر شیمیایی جدید را معرفی کردند. نخستین عنصر کشف شده پلونیوم نام داشت. ماری، به دلیل احترام به وطنش نام این عنصر جدید را پلونیم انتخاب کرد. تحقیقات این زوج نشان داد که عنصر پولونیم ۳۰۰ برابر بیشتر از اورانیوم پرتو ساطع میکند.
تولید عنصر پلونیوم
تولید عنصر پولونیم از طریق بمباران کردن بیسموت ۲۰۹ با نوترون در راکتورهای اتمی صورت می گیرد. دلیل این کار کمیابی این عنصر است. با این روش بیسموت ۲۱۰ ایجاد می شود و نیمه عمری برابر با ۵ روز دارد. سپس بر اثر تخریب با اشعه بتا بیسموت ۲۱۰ به پولونیم ۲۱۰ تبدیل می گردد. پولونیم ۲۱۰ نیمه عمری در حدود ۱۳۸٫۳۹ روز دارد.
منابع عنصر پولونیم
پلونیوم از عناصر بسیار کمیاب در طبیعت است. به طوری که در معادن اورانیوم (کانی اورانیت) با میزان ۱۰۰ میکرو گرم در هر تن یافت میشود. فراوانی طبیعی این عنصر در حدود ۰٫۲% عنصر رادیوم است. در سال ۱۹۳۴ همانطور که اشاره شد هنگامی که Bi209 توسط نوترون ها بمباران شود، Bi-210 به وجود می آید که به عنوان مادر پلونیوم شناخته می شود. امروزه عنصر پلونیوم در مقادیر میلی گرمی در فرایند ذوب نوترونی در راکتور های هسته ای بوجود می آید.
ویژگی عنصر پولونیم عنصر شماره ۸۴ جدول تناوبی مندلیف
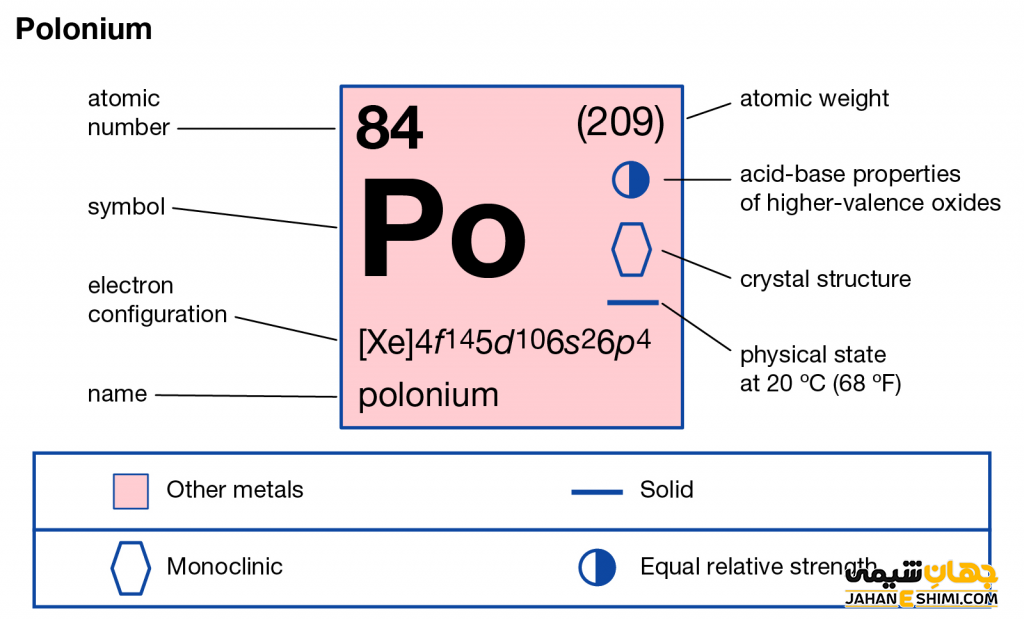
- عدد اتمی: ۸۴
- جرم اتمی (عدد جرمی): ۲۰۹
- گروه: ۱۶
- تناوب: ۶
- نقطه ذوب: ۲۵۴ درجه سانتی گراد
- نقطه جوش: ۹۶۲ درجه سانتی گراد
- شعاع اتمی: ۱۶۸ pm
- ظرفیت: ۴,۲
- رنگ: نقره ای
- حالت استاندارد (شرایط STP): جامد
- انرژی یونیزاسیون: ۸۱۲.۱ کیلوژول بر مول
- آرایش الکترونی: [Xe] 4f۱۴ ۵d۱۰ ۶s۲ ۶p۴
- الکترونگاتیویته: ۲ مقیاس پائولینگ
- حالت اکسیداسیون: ۴,۲
- چگالی: ۹٫۱۹۶ گرم بر سانتی متر مکعب
- آنتالپی تبخیر: ۱۰۲.۹۱ کیلوژول بر مول
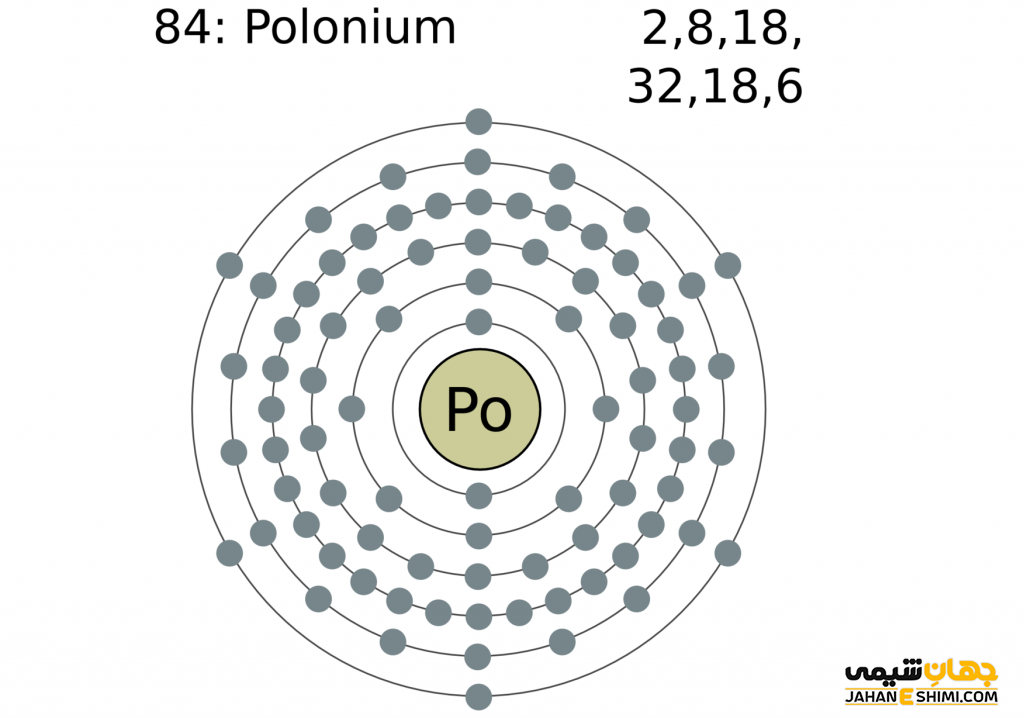
- لایه الکترونی: ۲, ۸, ۱۸, ۳۲, ۱۸, ۶
خواص عنصر پولونیم
عنصر پولونیم عنصر شماره ۸۴ جدول تناوبی است. از خواص عنصر پولونیم رادیو اکتیو بودن آن است. این ماده به سرعت در اسید های رقیق حل می شود. اما عنصر پلونیوم به مقدار بسیار کمی در قلیا که از نظر شیمیایی بسیار شبیه است به Bismuth و Tellurium قابل حل میشود. در pH تقریبا ۱، یون پولونیم هیدرولیز شده و با اسید هایی مانند اسید اگزالیک، اسید سیتریک و اسید تارتاریک ترکیب میشوند. از دیگر خواص عنصرپولونیم ۲۱۰ فلزی و سبک بودن آن است. به طوری که ۵۰% این ماده در هوا و بعد از ۴۵ ساعت قرار گرفتن در دمای ۳۲۸درجه کلوین بخار خواهد شد.
پولونیم یک عنصر رادیواکتیو است که به دو شکل فلزی وجود دارد. شکل آلفا و شکل بتا. بوسیله پراش پرتو ایکس و پراش الکترون ساختار عنصر پلونیوم مشخص شده است.
ایزوتوپ عنصر پلونیوم ساطع کننده آلفا است. نیمه عمر این ماده ۱۳۸٫۳۹ روز است. یک میلیگرم از این فلز سبک می تواند ذرات آلفا به میزان ۵ گرم رادیوم را از خود ساتع کند. در هنگام تجزیه این ماده، انرژی بسیار زیاده ساتع می شود. به طوری که نیم گرم از آن به سرعت به دمای بالای ۷۵۰ درجه کلوین خواهد رسید. چند Curie (واپاشی هسته ای در ثانیه) پلونیوم نوری آبی رنگ ساتع میکند. این نور آبی رنگ به آشفتگی و برانگیختگی هوای مجاور منجر میشود. برای شناخت بیشتر عنصر پلونیوم به مدل اتمی بور برای عنصر پولونیم مراجعه کنید.
ایزوتوپ عنصر پولونیم
عنصر پولونیم بیشتر از تمامی عناصر دیگر ایزوتوپ دارد. تمام این ایزوتوپ ها رادیو اکتیو هستند. برای پلونیوم بیش از ۲۵ ایزوتوپ با جرم اتمی ۱۹۴ تا ۲۱۸ شناخته شده است. در دسترسترین نوع این ایزوتوپ ها Po210 آن است. ایزوتوپ های po209 با نیمه عمر ۱۰۳ سال و Po 208 با نیمه عمر ۲٫۹ سال توسط بمباران سرب یا بیسموت در یک سیکلوترون بوجود میآیند. اما لازم به ذکر است که هزینه ساخت این ایزوتوپ ها بسیار گران است.
| نیمه عمر | ایزوتوپ |
| ۸.۸ روز | Po-206 |
| ۵.۸ ساعت | Po-207 |
| ۲.۸۹ سال | Po-208 |
| ۱۰۲ سال | Po-209 |
| ۱۳۸.۳۸ روز | Po-210 |
| ۰.۵۱ ثانیه | Po-211 |
| ۰.۲۹ میکروثانیه | Po-212 |
| ۴ میکروثانیه | Po-213 |
| ۱۶۳.۷ میکروثانیه | Po-214 |
| ۱.۷۸ میلی ثانیه | Po-215 |
| ۰.۱۴ ثانیه | Po-216 |
| ۳.۱ دقیقه | Po-218 |
کاربرد ایزوتوپ عنصر پولونیم
ایزوتوپ پولونیم-۲۱۰ یکی از ایزوتوپ های عنصر پلونیوم است. طی واپاشی آلفا این نوکلید به نوکلید پایدار ۲۰۶Pb با نیمه عمری برابر با ۱۳۸٫۳۷۶ تبدیل می گردد. در بین ایزوتوپ های طبیعی ایزوتوپ پولونیوم-۲۱۰ طولانی ترین نیمه عمر را داراست. این ایزوتوپ نخستین بار در سال ۱۸۹۸ شناسایی و منجر به کشف عنصر پولونیوم شد. در زنجیره واپاشی اورانیوم ۲۳۸ و رادیوم ۲۲۶، ۲۱۰Po تولید میشود.
۲۱۰Po به عنوان آلاینده ای مهم در محیط زیست بشمار می آید. بیشتر تاثیر آن نیز بر غذا های دریایی و تنباکو است. سمیت شدید ۲۱۰Po به پرتوزایی بالای مرتبط است و میتواند به انسان آسیب های جدی وارد کند.
۲۱۰Po حتی در سال ۱۹۴۳ به عنوان آغازگر احتمالی نوترون در سلاح های هسته ای نیز مورد مطالعه قرار گرفت. در مورد ایمنی کارگرانی که با ۲۱۰Po کار میکردند نگرانی هایی ایجاد گردید. این نگرانی ها به مطالعات گسترده در مورد اثرات بهداشتی ۲۱۰Po انجامید.
در دهه ۱۹۵۰ دانشمندان انرژی اتمی کاربرد ۲۱۰Po در مولد های گرما الکتریکی ایزوتوپی (RTG) را به عنوان منبع گرما جهت تأمین انرژی ماهواره ها بررسی کردند.
در سال ۱۹۵۸ یک باتری اتمی ۲٫۵ واتی نیز با کاربرد ۲۱۰Po تولید شد. اما ایزوتوپ پلوتونیم-۲۳۸ به جای آن انتخاب گشت. زیرا نیمه عمر آن برابر با ۸۷٫۷ سال است.
۲۱۰Po برای کشتن سران سیاسی در سال ۲۰۰۶ و همین طور ۲۰۱۲ مورد استفاده قرار گرفته است.
کاربرد عنصر پولونیم
کاربرد عنصر پولونیم با برلیوم، آلیاژی تشکیل می دهد که میتواند منبعی از نوترون باشد.
کاربرد عنصر پولونیم در ساخت تجهیزاتی که بار الکتریکی استاتیک را در کارخانجات از بین میبرند، استفاده میشود. توجه شود که از منابع بتا بیشتر استفاده می شود. زیرا خطر کمتری دارند.
کاربرد پلونیوم در ساخت تجهیزاتی صورت می گیرد که گرد و غبار انباشته شده بر روی فیلم های عکاسی را می زدایند. البته مقدار پلونیوم بکار رفته در این تجهیزات کم است و بنابراین خطر پرتوزایی بسیار کمی دارند.
کاربرد عنصر پولونیم به عنوان یک منبع گرمایی سلول های ترمومتریک در ماهواره های مصنوعی پیشنهاد میشود. زیرا با ظرف های معمولی می توان تابش تمام پرتو آلفا را متوقف کرده و با حرارت دادن سطح آن انرژی آزاد نمود.
از کاربرد پولونیم در ساخت شمع خودرو نیز استفاده شده است. دلیل کاربرد پولونیوم این بود که هوا را یونیزه می کند. بدین ترتیب مدت زمان جرقه طولانی تر و کارساز تر خواهد شد.
تاثیر عنصر پولونیم بر سلامتی
بعضی از آزمایشگاه های هسته ای عنصر پولونیم را مورد بررسی قرار گرفته داده اند. در کاربرد عنصر پولنیوم به خاطر رادیواکتیویته بالا و تابش اشعه آلفا باید روش های ویژه ای را استفاده شود.
۲۱۰Po در دود سیگار
۲۱۰Po تنها بخشی از دود سیگار است که تنفس آن در جانوران آزمایشگاهی باعث ایجاد سرطان خواهد شد. نرخ رشد سرطان ریه در بین مردان امریکایی از تعداد اندک در سال ۱۹۳۰ به مقدار زیادی در سال ۱۹۸۰ افزایش یافته است. میزان استعمال سیگار ۲۰% کاهش یافته است. اما میزان عنصر پولونیم-۲۱۰ در شرکت های دخانیات آمریکا سه برابر شده است.
هنگام تجزیه رادون عنصر دختر که از نظر الکتریکی باردار است، به ذرات گرد و غبار متصل شده و به کرک های برگ های توتون می چسبد. بنابراین روی این برگ ها رسوباتی از پولونیم و سرب رادیواکتیو تشکیل خواهد شد. در ادامه با مصرف سیگار و در اثر گرمای شدید آن، فلز رادیو اکتیو بخار می شود. البته فیلتر های سیگار مواد سرطان زا را به دام می اندازند. اما این فیلتر ها در برابر بخارات رادیواکتیو ناتوانند.
آستری رادیواکتیو با غلظت بسیار بالای رادون در ریه های افراد سیگاری ایجاد می شود. مصرف دو بسته سیگار در طول روز حدود ۱۳۰۰ میلی گرم ذرات آلفا در سال تابش می کند.
پولونیم-۲۱۰ محلول است و غلظت بالایی از آن می تواند در بدن چرخش کرده و وارد تمام بافت ها و سلول ها شود. رادون در خون و ادرار سیگاری ها یافته می شود.
خطرات ۲۱۰Po
گردش عنصر پولونیم-۲۱۰ آسیب و تغییرات ژنتیکی را نیز باعث می شود.
در اثر پولونیم-۲۱۰ بیماری هایی مانند سرطان کبد و مثانه، زخم معده، سرطان خون، سیروز کبد و بیماری های قلبی و عروقی و مرگ زودرس رخ می دهد.
رادیواکتیویتی منجر به ایجاد حداقل ۹۰% از سرطان های ریوی مربوط به سیگار است. بررسی ها نشان داده است که ۳۰% از مرگ های ناشی از سرطان در اثر استعمال سیگار رخ می دهند.
هشدار
عنصر پلونیوم عنصری بسیار رادیواکتیو و سمی است. درواقع کار کردن با عنصر پلونیوم بسیار خطرناک است. حتی مقادیر میلی گرمی یا میکروگرمی پلونیوم ۲۱۰ نیز بسیار خطرناک است. کار با ۲۱۰Po نیاز به رعایت کامل نکات ایمنی دارد.
آسیب های جدی از جذب انرژی توسط بافت های سلولی از طریق ذرات آفا وجود دارد. مقدار مجاز عنصر پلونیوم برای بدن تنها ۰.۰۳ میکروکوری می باشد.
درباره عناصر شیمیایی
جهان هستی از عناصر مختلف شکل یافته است. بدون عناصر شیمیایی جهان شکل نمی گرفت. بنابراین شناخت عناصر شیمیایی از ملزومات گسترش علم و دانش است. برای شناخت راحت تر این عناصر شیمیایی در جدولی به نام جدول تناوبی مندلیف چیده شده اند. بنابراین جدول تناوبی مندلیف شامل عناصر گوناگونی می شود. عناصر این جدول از لحاظ خواص فیزیکی و شیمیایی با یکدیگر تفاوت دارند. برای پی بردن به کاربرد و همین طور خطرات این عناصر باید به شناخت درست آن ها پرداخت. علاوه بر خواص مختلف این عناصر حالات مختلفی را در شرایط استاندارد خواهند داشت. جامد، مایع، گاز، حالت های مختلف این عناصر است. برخی از عناصر جدول تناوبی فلز و برخی نافلز و برخی از عناصر نیز شبه فلز هستند.
اغلب عناصری که در یک گروه از جدول تناوبی قرار دارند، ویژگی های فیزیکی و شیمیایی نزدیک به هم دارند. برای شناخت جایگاه این عناصر می توان به جدول تناوبی مندلیف مراجعه کرد. کاربرد عناصر در صنایع و کارخانه ها، سلامت و پزشکی و کشاورزی و… با شناخت کامل عناصر و خطرات آن ها امکان پذیر است. درواقع توسعه علم به توسعه و پیشرفت بیشتر جوامع انسانی خواهد انجامید.
سخن آخر
اهمیت عناصر و شناخت آن ها در پیشرفت علم و همینطور صنعت منجر شده است تا نشریه علمی جهان شیمی فیزیک به بررسی عناصر جدول تناوبی مندلیف بپردازد. جهت آشنایی با خواص و کاربرد و تاریخچه عناصر شیمیایی به سایت نشریه علمی جهان شیمی فیزیک مراجعه کرده و اطلاعات علمی خود در زمینه عناصر را افزایش دهید.



















