واکنش دهنده چیست؟ واکنش دهنده و فرآورده در واکنش شیمیایی

واکنش دهنده و فرآورده دو جزء اصلی یک واکنش شیمیایی هستند. واکنش دهندهها مواد اولیه یک واکنش شیمیایی هستند. فرآورده ها گونه های شیمیایی هستند که پس از اتمام واکنش تولید می شوند.
کل جهان از مواد شیمیایی مختلف تشکیل شده است. این عناصر شیمیایی دستخوش تغییرات متعددی می شوند که واکنش شیمیایی نامیده می شود. واکنش های شیمیایی بخش مهمی از زندگی روزمره ما است. به عنوان مثال مکانیسم سوزاندن سوخت به ما اجازه می دهد از اتومبیل استفاده کنیم یا از آن گرما تولید کنیم.
تفاوت بین واکنش دهندهها و محصولات این است که عامل شروع کننده یک واکنش شیمیایی واکنش دهندهها هستند. فرآورده ها گونه های شیمیایی هستند که پس از اتمام واکنش یافت می شوند. واکنش های شیمیایی شامل واکنش های اسیدی- باز، واکنش های اکسیداسیون و واکنش های احتراق هستند که فرآورده های مختلفی را ارائه می دهد.
بزرگترین تمایز واکنش دهنده و فرآورده این است که واکنش دهندهها در طول واکنش جذب می شوند در حالی که فرآورده ها طی واکنش تولید می شوند. برای کسب اطلاعات بیشتر در رابطه با واکنشن دهنده ها با این مقاله از نشریه جهان شیمی فیزیک همراه ما باشید.
تعریف واکنش دهنده
واکنش دهندهها گونه های شیمیایی هستند که به عنوان ماده اولیه یک واکنش شیمیایی عمل می کنند. واکنش دهنده ها در طول پیشرفت یک واکنش شیمیایی مصرف می شوند. در پایان واکنش، هیچ یک از آنها ممکن است در مخلوط واکنش وجود نداشته باشد اما گاهی اوقات برخی از واکنش دهندهها ممکن است در انتها وجود داشته باشند.
واکنش دهندهها می توانند بی رنگ یا رنگی باشند. بسته به نوع و شرایط واکنش، آنها می توانند در انتها فرآورده های بی رنگ یا رنگی ایجاد کنند. واکنش دهندههای یک واکنش شیمیایی می توانند در فاز جامد، فاز مایع یا فاز گازی باشند. با توجه به نوع واکنش، آنها متفاوت هستند.
از دیدگاه شیمی واکنش دهندهها مواد شیمیایی هستند که با هم ترکیب شده و یک ماده جدید تشکیل می دهند. به عنوان مثال، هوا از مواد شیمیایی مانند هیدروژن و اکسیژن تشکیل شده است. نمک، متشکل از مخلوطی از عناصر شیمیایی سدیم و کلرید است. این عناصر منحصر به فرد برای تشکیل ترکیبات شیمیایی جدید تحت واکنش شیمیایی قرار میگیرند. علاوه بر عناصر شیمیایی، مواد پیچیده تر مانند ترکیبات نیز می توانند به عنوان واکنش دهنده ها باشند.
جوش شیرین از اجزای زیادی از جمله سدیم، هیدروژن، کربن و اکسیژن تشکیل شده است. واکنش بین هیدروکسید سدیم و دی اکسید کربن شیمیایی است. دی اکسید کربن از یک کربن و دو مولکول اکسیژن تشکیل شده است. هنگامی که با این واکنش دهنده های شیمیایی ترکیب می شود، بی کربنات سدیم یا چیزی که به عنوان سودا شناخته می شود، ایجاد می شود.
شیمیدانان این واکنش ها را به صورت یک معادله شیمیایی به شیوه ای مجزا می نویسند. معادلات شیمیایی برای نشان دادن جهت واکنش از پیکان استفاده می کنند. این معادلات همچنین استفاده از سایر ترکیبات واکنش را نشان می دهند. کاتالیزورها، آنزیم ها، دما و سایر عواملی که می توانند بر روی برهم کنش مواد شیمیایی تاثیر بگذارند در معادله گنجانده می شوند.
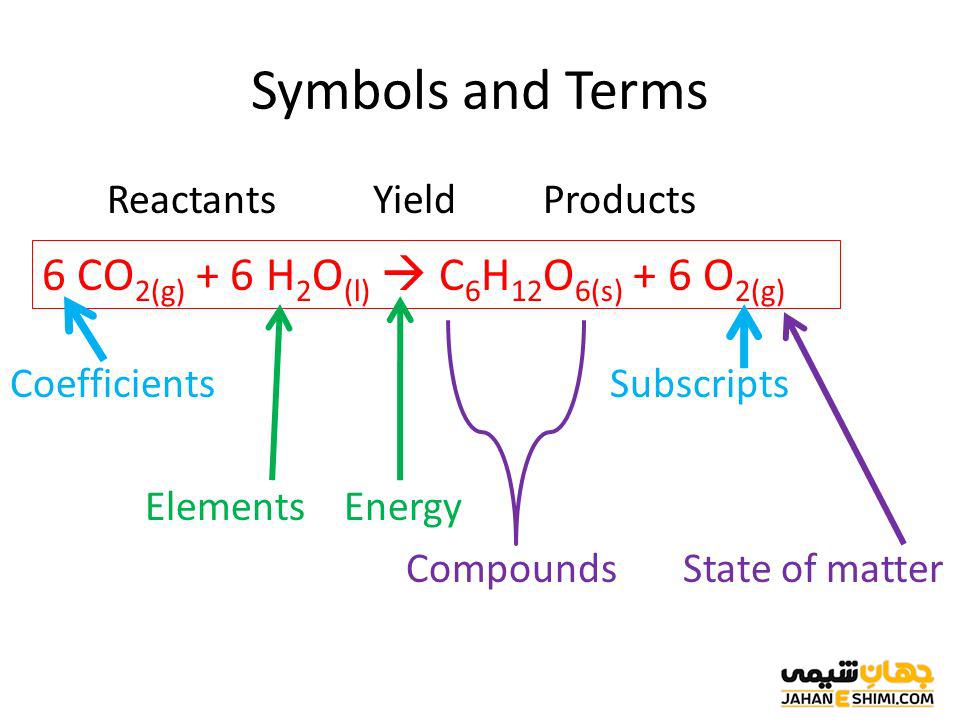
انواع واکنش ها و واکنش دهنده ها
واکنش های اسید و باز: واکنش دهندههای این واکنش ها اسیدها و بازها هستند.
واکنش های ردوکس: واکنش دهندهها عوامل اکسید کننده و عوامل کاهنده هستند. گاهی اوقات، محلول های بافر نیز برای حفظ pH مخلوط واکنش استفاده می شود.
واکنش های سنتز: واکنش دهندههای واکنش سنتز مولکول های کوچک تری نسبت به محصولات هستند.
واکنش های تجزیه: در واکنش های تجزیه، واکنش دهندهها مولکول های بزرگی نسبت به محصولات آن واکنش هستند.
واکنش های احتراق: واکنش دهندههای احتراق گونه های شیمیایی بسیار قابل اشتعال هستند.
واکنش های بارش: در بیشتر مواقع، واکنش دهندههای واکنش بارش مایعات هستند.
واکنش های گرمازا: واکنش دهندههای این واکنش های شیمیایی دارای انرژی بالقوه بالاتری نسبت به محصولات هستند.
واکنش های گرمازا: واکنش دهندههای این واکنش ها دارای انرژی پتانسیل پایینی نسبت به محصولات هستند.
شدت واکنش نیز تحت تاثیر واکنش دهندهها قرار می گیرد. در واقع سرعت یک واکنش خاص به انرژی بالقوه واکنش دهنده ها بستگی دارد.
تعریف فرآورده
فرآورده یا محصولات موادی هستند که در نتیجه واکنش شیمیایی ایجاد می شوند. این فرآورده ها می توانند یون یا مولکول باشند. فرآورده یک واکنش شیمیایی خاص می تواند در فاز جامد، فاز مایع یا فاز گازی رخ دهد.
فرآورده ها می توانند بی رنگ یا رنگی باشند. رنگ محصول بستگی به انواع واکنش دهنده های دخیل در واکنش دارد. مقدار فرآورده های موجود در مخلوط واکنش همیشه با پیشرفت واکنش افزایش می یابد.
به عنوان مثال کاتالاز یک آنزیم تولید شده توسط باکتری ها است که با تجزیه پراکسید هیدروژن آن را به آب و اکسیژن تبدیل می کند. با این حال واکنش های شیمیایی پیچیده تر و چند مرحله ای و ترکیبات نیز می توانند به عنوان واکنش دهنده استفاده شوند که طبیعتا فرآورده های پیچیده تری تولید می کنند.
انواع واکنش ها و فرآورده آنها
واکنش های اسید و باز: فرآورده این واکنش ها همیشه نمک و آب هستند.
واکنش های ردوکس: فرآورده ها اکسید شده و واکنش دهندهها احیاء می شوند. اغلب اوقات آب به عنوان محصول تولید می شود.
واکنش های سنتز: فرآورده واکنش های سنتز،مولکول های بزرگی نسبت به واکنش دهندهها هستند.
واکنش های تجزیه: در واکنش های تجزیه، فرآورده ها مولکول های کوچکی نسبت به واکنش دهندهها هستند.
واکنش های احتراق: فرآورده واکنش های احتراق اغلب دی اکسید کربن و آب در احتراق کامل (هیدروکربن ها) و مونوکسید کربن در احتراق ناقص هستند.
واکنش های بارش: فرآورده های واکنش های بارش، رسوبات یا سوسپانسیون های جامد هستند.
واکنش های گرمازا: فرآورده این واکنش های شیمیایی دارای انرژی پتانسیل کمتری نسبت به واکنش دهندهها هستند.
واکنش های گرمازا: فرآورده حاصل از این واکنش ها دارای انرژی بالقوه بالاتری نسبت به واکنش دهندهها هستند.
میزان واکنش را می توان با مقدار فرآورده تشکیل شده در یک دوره زمانی خاص تعیین کرد. در بیشتر مواقع ، محصولات اشکال پایدارتر از واکنش دهنده هستند. در واقع واکنش دهندهها برای به دست آوردن حالت پایدار تحت واکنش های شیمیایی قرار می گیرند.
شباهت های واکنش دهنده و فرآورده
- واکنش دهندهها و فرآورده می توانند اتم، یون یا مولکول باشند.
- هر دو واکنش دهنده و فرآورده در مخلوط واکنش وجود دارند.
- برای تعیین سرعت واکنش شیمیایی می توان از واکنش دهندهها و فرآورده ها استفاده کرد.
تفاوت بین واکنش دهنده و فرآورده
واکنش دهندهها گونه های شیمیایی هستند که به عنوان ماده اولیه یک واکنش شیمیایی عمل می کنند و در طول واکنش مصرف می شوند. مقدار واکنش دهندههای موجود در مخلوط واکنش به سرعت یا به آرامی در طول واکنش کاهش می یابد. در آغاز واکنش، فقط واکنش دهندهها در مخلوط واکنش وجود دارند. در انتهای واکنش، واکنش دهندهها ممکن است در مخلوط واکنش وجود داشته باشند یا نداشته باشند.
فرآورده ها محصولات موادی هستند که در نتیجه واکنش شیمیایی ایجاد می شوند و در واکنش مصرف نمی شوند. مقدار محصولات موجود در مخلوط واکنش به سرعت یا به آرامی در طول واکنش افزایش می یابد. در آغاز واکنش، فرآورده ها در مخلوط واکنش وجود ندارد. در پایان واکنش، فرآورده ها در مخلوط واکنش وجود دارند.
واکنش دهنده و فرآورده در واکنش های شیمیایی
در یک واکنش شیمیایی، موادی (عناصر و یا ترکیبات) که واکنش دهنده نامیده می شوند به مواد دیگر (ترکیبات و یا عناصر) به نام فرآورده تبدیل می شوند. شما نمی توانید یک عنصر را در واکنش شیمیایی به عنصر دیگر تبدیل کنید – این در واکنش های هسته ای اتفاق می افتد. در عوض یک ماده جدید را می توانید با واکنش های شیمیایی ایجاد می کنید.
تعدادی از سرنخ ها نشان می دهد که یک واکنش شیمیایی رخ داده است، به عنوان مثال:
- چیز جدیدی به وضوح تولید می شود
- گاز ایجاد می شود
- گرما آزاد یا جذب می شود
معادلات شیمیایی واکنش دهنده ها و فرآورده ها و همچنین عوامل دیگر مانند تغییرات انرژی، کاتالیزورها و غیره را نشان می دهد. این معادلات از یک پیکان برای نشان دادن یک واکنش شیمیایی استفاده می شود. به طور کلی، یک واکنش شیمیایی از قالب زیر پیروی می کند:
محصولات → واکنش دهنده ها
برای مثال، به عکس العملی که هنگام روشن کردن گاز طبیعی ایجاد می شود، نگاهی بیندازید. متان (گاز طبیعی) با اکسیژن موجود در جو واکنش داده و دی اکسید کربن و بخار آب تولید می کند. معادله شیمیایی که نشان دهنده این واکنش است به این صورت نوشته شده است:
CH4 +2 O2 → CO2+ 2 H2O
می توانید معادله را این گونه بخوانید، یک مولکول گاز متان با دو مولکول گاز اکسیژن واکنش داده و یک مولکول گاز دی اکسید کربن و دو مولکول بخار آب را تشکیل می دهد. ۲ در مقابل گاز اکسیژن و ۲ در مقابل بخار آب ضرایب واکنش نامیده می شود. آنها تعداد هر گونه شیمیایی را نشان می دهند که طی واکنش مصرف یا تشکیل می شوند.
متان و اکسیژن واکنش دهنده هستند در حالی که دی اکسید کربن و آب فرآورده هستند. همه واکنش دهنده ها و محصولات گازها هستند
در این واکنش همه واکنش دهنده ها و محصولات نامرئی هستند. گرمای در حال افزایش نشانه ای است که به شما می گوید واکنش در حال انجام است. این یک مثال خوب از واکنش گرمازا است، واکنشی که در آن گرما تولید می شود. بسیاری از واکنش ها گرمازا هستند. با این حال، برخی واکنش ها به جای آزادسازی انرژی، آن را جذب می کنند. این واکنش ها را واکنش های گرما گیر می نامند.
تشخیص واکنش دهنده و فراورده
نقطه یابی واکنش دهنده ها در یک معادله شیمیایی مانند شناسایی موضوع در یک جمله است. آنها معمولاً در سمت چپ معادله، قبل از فلش، فهرست میشوند و نشان میدهند که با چه چیزی شروع میکنید. به عنوان مثال، در معادله H2 + O2 → H2O، H2 و O2 واکنش دهنده هایی هستند که به آب H2O تبدیل می شوند. آب نیز به عنوان فراورده شناخته می شود. همه واکنش های شیمیایی یکسان ایجاد نمی شوند. برخی انرژی آزاد می کنند، مانند آتش سوزی (گرمازا)، در حالی که برخی دیگر انرژی را جذب می کنند و در لمس احساس سردی می کنند (گرماگیر). همه چیز در مورد جریان انرژی بین واکنش دهنده ها و محصولات است. واکنش های شیمیایی فقط آزمایش های آزمایشگاهی نیستند. آنها همه جا هستند! از زنگ زدن فلز، فتوسنتز در گیاهان، تا پخت نان، نقش مهمی در دنیای ما دارند. درک واکنش دهندهها و فراورده ها به ما کمک می کند تا مواد، داروها و حتی جرایم را در علم پزشکی قانونی حل کنیم.
در واقع واکنشدهنده ها خط شروع مسابقه واکنش های شیمیایی هستند که از طریق فرآیندهای جذاب به محصولات یا فراورده ها تبدیل می شوند. با کاوش و درک این مواد اولیه می توانید بفهمید که اسرار شیمی را که به روشهای باورنکردنی بر جهان ما تأثیر می گذارد. بنابراین، دفعه بعد که یک معادله شیمیایی را مشاهده کردید یا متوجه واکنشی در اطرافتان شدید، به واکنشدهندهها و نقش حیاتی آنها فکر کنید. همچنین فراورده ها را نیز شناسایی کنید.
نتیجه گیری
واکنش دهندهها و فرآورده ها اجزای ضروری یک واکنش شیمیایی هستند. واکنش دهندهها با یکدیگر واکنش نشان می دهند و در نتیجه فراورده ها را تولید می شوند. با این حال، واکنش دهندهها فقط بر اساس استوکیومتری واکنش نشان داده می شوند. گاهی اوقات ممکن است مقدار یک واکنش دهنده خاص برای واکنش کامل با واکنش دهنده دیگر کافی نباشد. در این صورت، هر دو محصول و مقداری از واکنش دهنده اضافی در انتهای واکنش وجود خواهد داشت. اما در اینجا واکنش دهنده باقی مانده به عنوان محصول واکنش در نظر گرفته نمی شود زیرا در نتیجه واکنش ایجاد نمی شود. بنابراین درک تفاوت بین واکنش دهنده ها و فرآورده ها بسیار مهم است.



















