خواص عنصر هولمیم چیست؟ کاربرد هولمیم را می شناسید؟

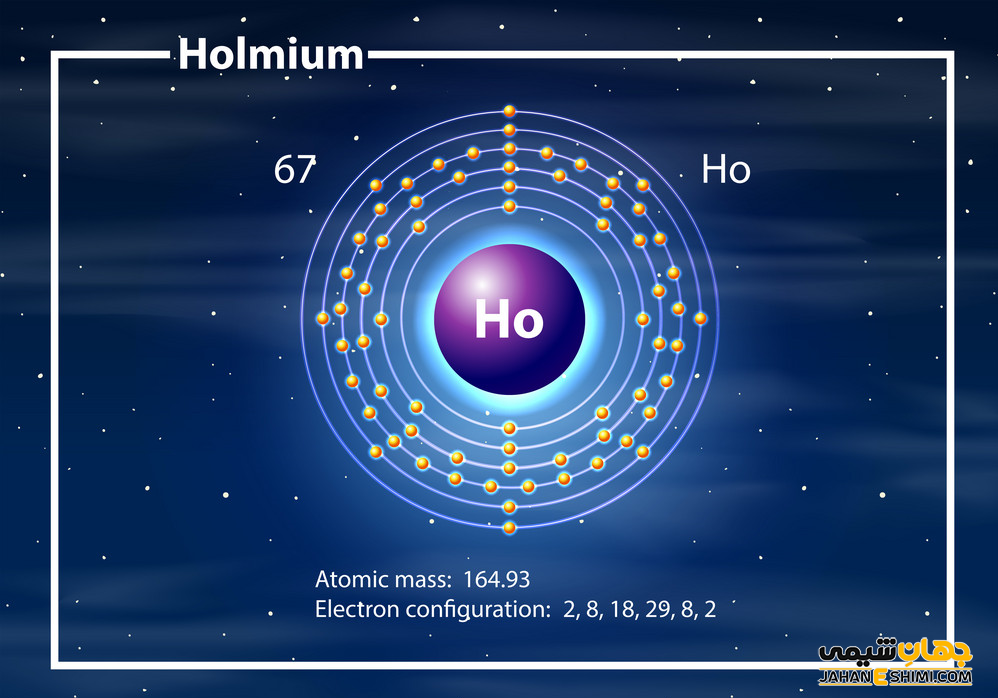
عنصر هولمیم از عناصر شیمیایی جدول تناوبی عناصر بوده و با نماد شیمایی Ho شناخته می شود. عدد اتمی عنصر هولمیم ۶۷ و عدد جرمی آن ۱۶۴.۹۳ است. خواص عنصر هولمیم موجب شده است تا در گروه ۳ و تناوب ۶ جدول تناوبی مندلیف جای بگیرد. عنصر هولمیم از فلزات واسطه داخلی بوده و در دسته لانتانید ها جای دارد. از خواص عنصر هولمیم می توان اشاره نمود که جامدی بلوری با جلای نقره ای است. از کاربرد عنصر هولمیم می توان به استفاده از آن در پژوهشگاه های الکتروشیمی و اسپکتروسکوپی اشاره نمود. ترکیباب عنصر هولمیم مختلفی شناخته شده اند مانند نمک عنصر هولمیم. این ماده فلز و از عناصر کمیاب است. ایزوتوپ عنصر هولمیم نیز شناسایی شده است اما پایداری چندانی ندارد. برای شناخت بیشتر عنصر هولمیم در ادامه با ما همراه باشید.
نشریه علمی جهان شیمی فیزیک به معرفی خواص و کاربرد عناصر جدول تناوبی پرداخته است. عناصری مانند: دیسپروزیم، تربیوم، عنصر گادولینیم و… .
تاریخچه عنصر هولمیم
عنصر هولمیم در سال ۱۸۷۸ تـوسط Marc Delafontaine و Jacques Louis Soret کشف شد. آن ها نوار های طیف جذبی خاص این عنصر را که در آن زمان ناشناخته بود، شناسایی کردند. این دو دانشمند این ماده را عنصر X نامیدند. بعد از آن ها در سال ۱۸۷۸ دانشمندی به نام Per Theodor Cleve به طور جداگانه و هنگامیکه مشغول کار بر روی اکسید اربیم بود، این عنصر را کشف کرد. نام عنصر هولمیم از واژه لاتین Holmia به معنی استکهلم گرفته شده است.
Cleve با بهره گیری از روشی که توسط Carl Gustaf Mosander ابداع شده بود توانست تمام ناخالصی ها را از erbia خارج نماید. با حذف ناخالصی ها دو ماده معدنی جدید با رنگ های قهوه ای و سبز حاصل آمد. Cleve ماده قهوه ای را holmia (برگرفته از نام زادگاهش یعنی استکهلم) و ماده سبز رنگ را thulia نامگذاری کرد. بعد ها مشخص شد که Holmia همان اکسید هولمیم و thulia همان اکسید تالیم است.
منابع عنصر هولمیم
همانند تمامی عناصر خاکی (لانتانید ها)، عنصر هولمیم نیز کمیاب بوده و در طبیعت به صورت آزاد وجود ندارد. این ماده به صورت ترکیب با عناصر دیگر یافته می شود. این ماده در کانی های گادولینیت و مونازیت و سایر کانی های خاکی کمیاب یافت میشود.
تولید
عنصر هولمیم از شن مونازیت بهصورت تجاری با روش جابجایی یونی جداسازی می شود. هولمیم به دست آمده حدود ۰۵/۰% خواهد بود. به طور کلی جداسازی این عنصر از سایر کانی های خاکی کمیاب دشوار است.
این عنصر را با روش کاهش کلرید و فلوئورید آن بهوسیله کلسیم فلزی می توان تهیه نمود. مقدار این ماده در پوسته زمین ۱,۳ میلی گرم در هر کیلو تخمین زده شده است.
عنصر هولمیم عنصر شماره ۶۷ جدول تناوبی عناصر
- عدد اتمی: ۶۷
- جرم اتمی: ۱۶۴.۹۳
- گروه: ۳
- تناوب: ۶
- نقطه ذوب: ۱۴۶۱ درجه سانتی گراد
- نقطه جوش: ۲۷۲۰ درجه سانتی گراد
- شعاع اتمی: ۱۷۶ pm
- رنگ: سفید نقره ای
- حالت استاندارد شرایط (STP): جامد
- انرژی یونیزاسیون: Kj/mol 580
- آرایش الکترونی: [ Xe ] 4f۱۱ ۶s۲
- الکترونگاتیوی: ۱٫۲ مقیاس پائولینگ
- حالت اکسیداسیون: ۳
- چگالی: ۸.۷۹ گرم بر سانتی متر مکعب
- آنتالپی تبخیر: ۲۶۵ Kj/mol
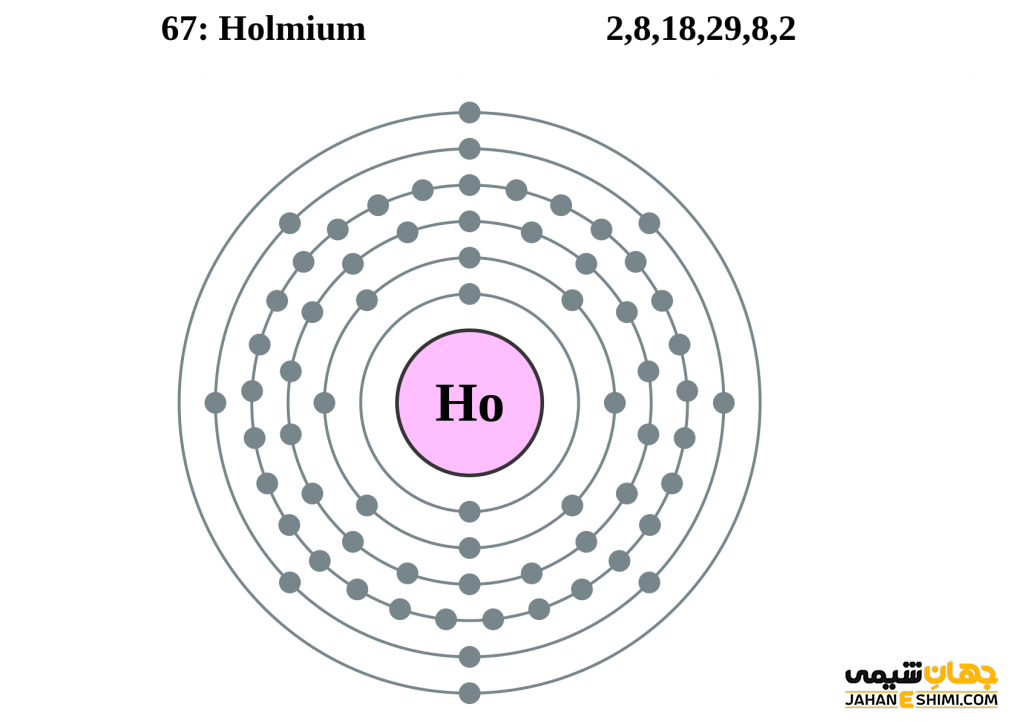
- لایه الکترونی: ۲, ۸, ۱۸, ۲۹, ۸, ۲
خواص عنصر هولمیم
عنصر هولمیوم یک عنصر فلزی خاکی سه ظرفیتی است. از خواص عنصر هولمیم این است که در بین تمامی عناصر طبیعی دارای بیشترین گشتاور مغناطیسی است. البته این ماده خصوصیات مغناطیسی غیر عادی دیگری نیز دارد. در صورت ترکیب عنصر هولمیم با ایتریوم، ترکیباتی تولید می شوند که به شدت مغناطیسی هستند. این ماده در دسته لانتانید ها قرار داشته و عنصری نسبتا نرم و چکشخوار است. این ماده در هوای خشک و در فشار و دمای معمولی تاحدودی پایدار و در برابر فرسایش نیز مقاوم است. لازم به ذکر است که این ماده در هوای مرطوب و در دمای زیاد به سرعت اکسید میشود. اکسید این ماده به رنگ زرد کم رنگ است. هولمیم فلزی در حالت خالص درخششی نقره ای رنگ دارد. برای شناخت بیشتر خواص و کاربرد عنصر هولمیم می توان به مدل اتمی بور اشاره نمود.
خواص لانتانیدها
عناصر گروه لانتانید ها (عناصر واسطه داخلی) با نام خاک های کمیاب نیز شناخته می شوند. اولین اعضای لانتانید ها که به صورت اکسید جمع آوری شد، شبیه به اکسید های کلسیم و منیزیم (بعد ها در گروه فلزات قلیایی خاکی قرار گرفتند) بودند. علت این نام گذاری همین موضوع است. منابع لانتانید ها در طبیعت کانی هایی چون مونازیت، زنوتیم و گادولینیت است.
گروه لانتانید ها شامل ۱۴ عنصر فلزی می شود. تمام عناصر این دسته، فلزاتی براق با واکنش پذیری بالا هستند. خواص این عناصر واسطه داخلی (لانتانید ها) شبیه خواص عنصر لانتان با عدد اتمی ۵۷ است. این عناصر نمک های سه ظرفیتی محلول در آب با خواص شیمیایی یکسانی را به وجود می آورند. لازم به ذکر است که این عناصر قابل احیا شدن نیز هستند. با استفاده از اثر کلسیم و لیتیم بر هالید بدون آب این کار صورت می پذیرد. در مرحله بعد آن را در خلأ ذوب مجدد نموده تا باقیمانده مواد احیا کننده تبخیر شود. این مواد می توانند از طریق حمام های نمک ذوب شده به صورت الکترولیتی نیز احیا شوند. بعلاوه لانتانید ها می توانند با برخی ترکیبات آلی املاح آلی تشکیل دهند.
ایزوتوپ عنصر هولمیم
فلز هولمیم تنها یک ایزوتوپ پایدار به نام ۱۶۵Ho داراست. همچنین برخی از ایزوتوپ های رادیو اکتیو مصنوعی این ماده نیز شناسایی شده اند. پایدارترین این رادیوایزوتوپ ها، ایزوتوپ عنصر هولمیم -۱۶۳ است و نیمه عمری برابر با ۴۵۷۰ سال دارد.
| نیمه عمر | ایزوتوپ |
| ۴۵۷۰ سال | Ho-163 |
| پایدار | Ho-165 |
| ۱.۱ روز | Ho-166 |
| ۱۲۰۰ سال | Ho-166m |
واکنش های عنصر هولمیم
فلز هولمیوم به آرامی در هوا لکه دار شده و به راحتی هم می سوزد و ترکیب اکسید هولمیم (III) ایجاد می کند.
هولمیوم عنصری کاملا الکتروپوزیتیو است. این ماده به طور کلی سه ظرفیتی است. عنصر هولمیم به آرامی با آب سرد و خیلی سریع با آب گرم وارد واکنش می شود. در این صورت هیدروکسید هولمیوم ایجاد خواهد شد.
فلز واسطه داخلی هولمیوم با تمام هالوژن ها می تواند وارد واکنش شود.
هولمیم در اسید ها حل می شود. عنصر هولمیوم به راحتی در اسید سولفوریک رقیق حل شوده و محلول هایی حاوی یون های زرد (Ho (III تشکیل می دهد که به صورت کمپلکس وجود دارند.
متداول ترین حالت اکسیداسیون هولمیوم ۳+ است. این ماده در محلول به صورت Ho+۳ وجود داشته و توسط ۹ مولکول آب احاطه شده است.
کاربرد عنصر هولمیم
محلول اکسید هولمیوم ۴٪ در اسید پرکلریک ۱۰٪، به عنوان یک استاندارد کالیبراسیون نوری به طور دائم در یک کووت کوارتز ذوب شده است.
این عنصر بیشترین مقاومت مغناطیسی را نسبت به سایر عناصر داراست. بنابراین کاربرد عنصر هولمیم برای ایجاد قوی ترین میدان های مغناطیسی تولید شده مصنوعی صورت می گیرد.
هولمیم می تواند نوترون های شکافت یافته هسته ای را جذب کند. بنابراین از آن به عنوان سوخت برای تنظیم راکتورهای هسته ای استفاده می شود.
گارنت آهن ایتریوم دوپ شده هولمیم (YIG) و فلوراید لیتیوم ایتریوم (YLF) در لیزر های حالت جامد کاربرد دارند. Ho-YIG در تجهیزات مایکروویو نیز کاربرد دارند. کاربرد ترکیبات هولمیم در مصارف پزشکی، دندان پزشکی و فیبر نوری نیز صورت می گیرد.
هولمیوم از مواد رنگی است که برای شیشه استفاده می شود. با کاربرد عنصر هولمیوم رنگ زرد یا قرمز ایجاد می شود.
شیشه های حاوی محلول های اکسید هولمیم دارای قله جذب نوری تیز در محدوده طیفی ۲۰۰ تا ۹۰۰ نانومتر هستند. بنابراین می توان از آن ها به عنوان استاندارد کالیبراسیون برای اسپکتروفتومتر های نوری استفاده نمود.
خطرات عنصر هولمیم
باید گفت که این ماده نقش بیولوژیکی در انسان ندارد، اما نمک های آن قادر به تحریک متابولیسم هستند. انسان ها به طور معمول تنها حدود یک میلی گرم از کاربرد عنصر هولمیم در سال مصرف می کنند.
گیاهان نیز نمی توانند به راحتی هولمیوم را از خاک دریافت نمایند. محتوای هولمیم برخی از سبزیجات محاسبه شده است. مقدار این ماده به ۱۰۰ قسمت در تریلیون رسیده است.

خطرات عنصر هولمیم
مقادیر زیاد نمک هولمیم در صورت تنفس، مصرف خوراکی یا تزریق، منجر به آسیب جدی می شود. البته اثرات بیولوژیکی هولمیم برای مدت زمان طولانی مشخص نبوده ولی از سمیت حاد کمی برخوردار است.
سخن آخر
جدول تناوبی مندلیف عناصر مختلفی را در خود جای داده است. عناصر شیمیایی مختلف این جدول کاربرد و استفاده های متنوعی هم دارند. زیرا عناصر جدول تناوبی مندلیف از لحاظ خواص فیزیکی و شیمیایی با یکدیگر متفاوتند. درواقع کاربرد متنوع عناصر به دلیل تفاوت ها و ویژگی های فیزیکی و شیمیایی مختلف آن هاست. عناصری که در یک گروه از جدول تناوبی جای گرفته اند، اغلب خواص مشابهی هم دارند. برای شناخت بیشتر عناصر شیمیایی می توان به جدول تناوبی مندلیف مراجعه کرده و شباهت و تفاوت ها آن ها را بررسی نمود.
همه عناصر در جدول تناوبی جایگاه مخصوص به خود را دارند. با شناخت بهتر خواص عناصر جدول تناوبی می توان به کاربرد عناصر و استفاده بهینه از آن ها نیز پی برد. درواقع با شناخت دقیق عناصر است که کاربرد آن ها در صنعت و سلامت و پزشکی و کشاورزی و… ممکن خواهد بود. دانشمندان همواره در تلاشند تا با شناخت کامل این عناصر دریچه ای جدید بر علم و فناوری را بگشایند.
توجه
توجه شود که عناصر موجود در جدول تناوبی حالت (فاز) های مختلفی دارند. برخی از عناصر موجود در این جدول فلز و برخی دیگر نافلز و برخی هم شبیه فلز هستند. خواص فلزات و نافلزات با یکدیگر متفاوت است. برخی از عناصر موجود در جدول تناوبی گازی شکل و برخی دیگر جامدند. بنابراین با خواص متفاوت عناصر، بررسی و شناخت دقیق آن ها می توان به پیشرفت های فراوانی در علم و اقتصاد رسید.
به دلیل اهمیت بالایی که شناخت عناصر شیمیایی در زندگی روزمره و فناوری و صنعت دارد، نشریه علمی جهان شیمی فیزیک به توضیح و بررسی خواص و کاربرد عناصر پرداخته است. برای آشنایی با کاربرد و تاریخچه عناصر شیمیایی جدول تناوبی می توانید به سایت نشریه علمی جهان شیمی فیزیک مراجعه نموده و اطلاعات خود در زمینه عناصر جدول تناوبی را افزایش دهید.



















