کاربرد عنصر ساماریم (ساماریوم) چیست؟ ویژگی و خواص ساماریم

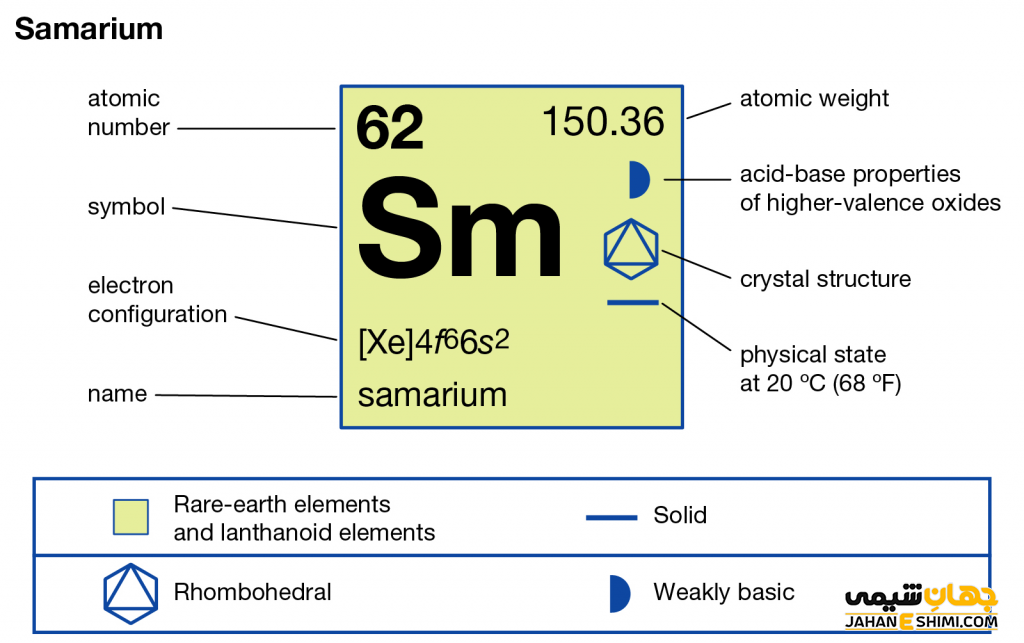
عنصر ساماریم یکی از عناصر شیمیایی جدول تناوبی مندلیف بوده و با نماد شیمیایی Sm شناخته می شود. عدد اتمی عنصر ساماریم ۶۲ و عدد جرمی آن ۱۵۰.۳۶ است. از خواص عنصر ساماریم می توان به رنگ سفید نقره ای آن اشاره کرد. ویژگی عنصر ساماریم موجب شده تا این عنصر در گروه ۳ و تناوب ۶ جدول مندلیف جای بگیرد. عنصر ساماریم (ساماریوم) به عنوان یک فلز از دسته لانتانید ها شناخته می شود. کاربرد عنصر ساماریم منجر شده است تا به بررسی این عنصر کمیاب بپردازیم. برای عنصر ساماریم چنین ایزوتوپ نیز معرفی شده است. لازم به ذکر است که در شرایط STP این فلز به صورت جامد وجود دارد. ترکیبات عنصر ساماریم مانند اکسید ساماریم نیز شناسایی شده و کاربرد دارند. برای شناخت بیشتر خواص این ماده می توان به مدل اتمی بور برای عنصر ساماریم اشاره نمود.
نشریه علمی جهان شیمی فیزیک به بررسی عناصر شیمیایی جدول تناوبی پرداخته است. عناصری مانند: پرومتیم، منیزیم، کلسیم، لیتیم و… . در ادامه با شناخت و معرفی کاربرد و خواص عنصر ساماریم با ما همراه باشید.
پیشینه عنصر ساماریم
اولین بار در سال ۱۸۵۳ توسط شیمیدان سوئیسی به نام Jean Charles Galissard عنصر ساماریوم کشف شد. این ماده با عمل جذب خطوط دیدیمیوم کشف شد. این ماده در سال ۱۸۷۹ دانشمندی فرانسوی به نام Paul Emile Lecoq De Boisbaudran جدا شده و کانی Samarskite را بوجود آورد.
عنصر ساماریوم هیچ وقت به صورت آزاد در طبیعت یافت نمیشود. اما این عنصر نیز مانند سایر عناصر کمیاب خاک کانی های گوناگونی را شامل میشود. Monazite، Bastnasite و Samarskite از کانی های شناخته شده این عنصر هستند. در بین این سه کانی، Monazite و Bastnasite کاربرد تجاری دارند. اخیرا عنصر ساماریم از طریق فرآیند های تبادل یونی و تکنیک های عصاره گیری مایعات و الکتروشیمی ایجاد می شود. همچنین عنصر ساماریوم می تواند با احیا لانتان نیز به دست آید.
منابع عنصر ساماریم
عنصر ساماریم پنجمین عنصر کمیاب بوده و تقریبا چهار برابر قلع یافت می شود. لازم به ذکر است که این ماده در طبیعت به صورت آزاد پیدا نمی شود. همانطور که گفته شد این عنصر را می توان از منابعی مانند: مواد معدنی مونازیت، باستناسیت و سامارسکیت بدست آورد.
در ایالات متحده آمریکا، چین، برزیل، هند، استرالیا و سریلانکا سنگ معدن ساماریم یافته می شود. تولید جهانی اکسید ساماریوم حدود ۷۰۰ تن در سال است. میزان ذخایر جهانی این عنصر در حدود ۲ میلیون تن تخمین زده شده است.
تولید عنصر ساماریوم
- از رسوب الکتروشیمیایی با استفاده از محلول الکترولیتی سیترات لیتیم و الکترود جیوه برای تولید فلز ساماریم نیز استفاده می شود.
- کاهش اکسید با لانتانیم می تواند باعث تولید این ماده گردد. ساماریوم طبیعی مخلوطی از چندین ایزوتوپ بوده و ۲۱ ایزوتوپ از این عنصر وجود دارد.
ویژگی عنصر ساماریم عنصر شماره ۶۲ جدول تناوبی
- عدد اتمی: ۶۲
- جرم اتمی: ۴/۱۵۰
- گروه: ۳
- تناوب: ۶
- نقطه ذوب : ۱۰۷۲ درجه سانتی گراد
- نقطه جوش : ۱۷۹۴ درجه سانتی گراد
- شعاع اتمی: ۱۸۰ pm
- ظرفیت: ۳ و ۲
- رنگ: سفید نقره ای
- حالت استاندارد (STP): جامد
- نام دسته: لانتانید ها
- آرایش الکترونی: [Xe] 4f۶ ۶s۲
- چگالی: ۷.۵۲ گرم بر سانتی متر مکعب
خواص عنصر ساماریم
عنصر ساماریم در انگلیسی با Samarium شناخته می شود. عنصر ساماریم عنصر شماره ۶۲ جدول تناوبی مندلیف است. عنصر ساماریوم از عناصر فلزی نادر است و درخشش نقره ای براقی دارد. حالت این ماده در شرایط STP جامد است. از خواص عنصر ساماریم می توان به پایداری قابل توجه در هوا اشاره کرد. این عنصر در هوا در ۱۵۰ درجه سانتی گراد آتش میگیرد. سه کریستال فلزی از این ماده نیز وجود دارد که در دمای ۷۳۴ و ۹۲۲ درجه تغییر میکنند. این ماده در دسته لانتانید ها قرار داشته و خواصی مشابه به سایر عناصر این گروه از فلزات واسطه داخلی را داراست. برای شناخت بیشتر خواص عنصر ساماریم می توان به مدل اتمی بور برای عنصر ساماریوم مراجعه نمود.
لانتانید ها و خواص
لانتانید ها عناصری در جدول تناوبی مندلیف هستند. این عناصر فلزاتی براق با واکنش پذیری بالا هستند. این عناصر خواصی مشابه لانتان ۵۷ دارند. عناصر این گروه نمک های سه ظرفیتی محلول در آب با خواص شیمیایی یکسان را ایجاد می کنند. این عناصر را می توان احیا نمود. با استفاده از اثر کلسیم و لیتیم بر هالید بدون آب این کار صورت می پذیرد. در مرحله بعد آن را در خلأ ذوب مجدد نموده و باقیمانده مواد احیا کننده تبخیر می شود. همچنین آن ها را می توان از حمام های نمک ذوب شده به صورت الکترولیتی نیز احیا کرد. لانتانید ها همچنین می توانند با بعضی ترکیبات آلی املاح آلی تشکیل دهند.
لانتانید ها خاک های کمیاب نیز نام گرفته اند. علت این نامگذاری این است که اولین اعضای لانتانید ها که به صورت اکسید جمع آوری شد شبیه به اکسید های کلسیم و منیزیم (بعد ها در گروه فلزات قلیایی خاکی قرار گرفتند) بود. لانتانید ها به صورت کانی هایی چون مونازیت، زنوتیم و گادولینیت در طبیعت یافت می شوند.
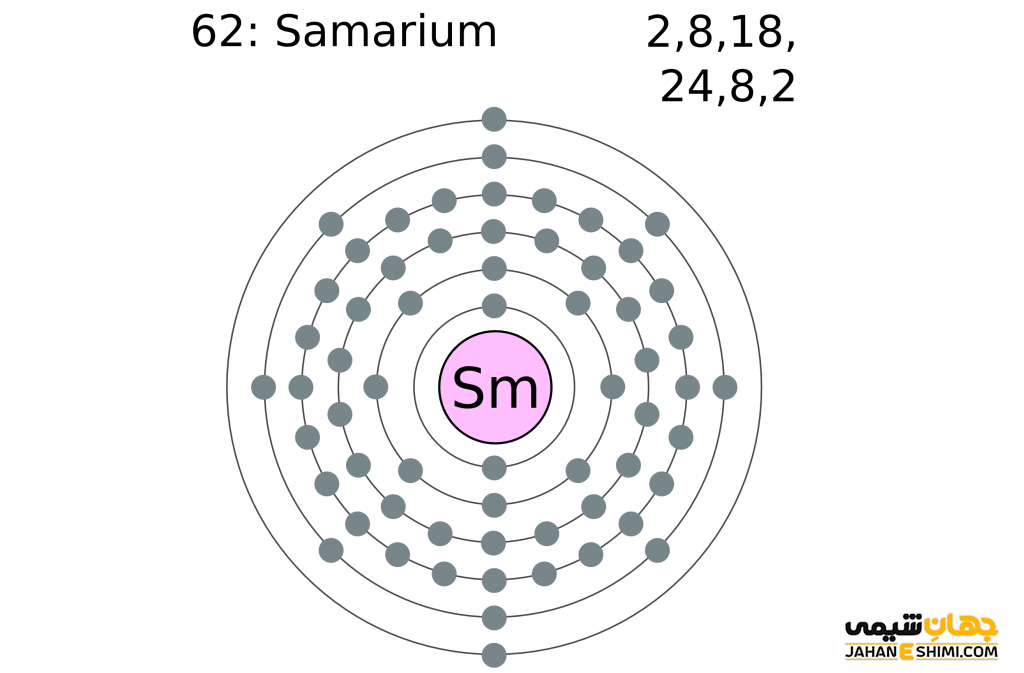
ایزوتوپ عنصر ساماریم
عنصر ساماریم ۵ ایزوتوپ پایدار به صورت ۱۵۲Sm، ۱۵۰Sm، ۱۴۹Sm، ۱۴۴Sm، ۱۵۴Sm است. در بین این ایزوتوپ ها ۱۵۲Sm با فراوانی طبیعی ۲۶٫۷۵٪ به عنوان فراوانترین ایزوتوپ این عنصر شناخته می شود. همچنین این ماده سه ایزوتوپ رادیواکتیو دارد. این ایزوتوپ ها شامل ۱۴۷Sm، ۱۴۸Sm، ۱۴۹Sm می باشد.
این عنصر پنج Meta State نیز دارد. حالت فروپاشی اولیه قبل از ایزوتوپ پایدار ۱۵۲Sm الکترون گیری و حالت اولیه بعد از آن Beta Minus Decay است. محصول فروپاشی اولیه قبل از ۱۵۲Sm ایزوتوپ های عنصر پرومتیم و محصول اولیه بعد از آن، ایزوتوپ های عنصر اروپیم هستند.
| نیمه عمر | ایزوتوپ |
| پایدار | Sm-144 |
| ۳۴۰ روز | Sm-145 |
| ۱.۰۳E8 سال | Sm-146 |
| ۱.۰۶E11 سال | Sm-147 |
| ۷.0E15 | Sm-148 |
| پایدار | Sm-149 |
| پایدار | Sm-150 |
| ۹۰ سال | Sm-151 |
| پایدار | Sm-152 |
| ۱.۹۲ روز | Sm-153 |
| پایدار | Sm-154 |
کاربرد عنصر ساماریم
کاربرد عنصر ساماریم نورپردازی با قوس کربن برای صنعت فیلم سازی را فراهم نموده است. این ماده قادر است ترکیبی با کبالت (SmCo۵) تشکیل دهد. این ترکیب یک آهنربا دائمی قدرتمند است و بیشترین مقاومت را در برابر مغناطیس زدایی مواد شناخته شده دارد.
از دیگر کاربرد عنصر ساماریم این است که به عنوان جاذب نوترون در راکتورهای هسته ای و شیشه های جذب مادون قرمز استفاده می شود.
ترکیبات ساماریم به عنوان حساس کننده فسفر های مادون قرمز تحریک شده عمل می کنند.
اکسید این فلز خواص کاتالیزوری را در از دست دادن آب مواد و دهیدروژناسیون الکل اتیل از خود بروز می دهد.
اکسید ساماریوم در شیشه های نوری برای جذب اشعه مادون قرمز استفاده می شود.
اکسید ساماریوم همچنین برای پیشگیری از کریستال فلوراید کلسیم برای استفاده در لیزرهای نوری یا لیزر استفاده می گردد.
تغلیظ کریستال های CaF۲ برای استفاده در لیزرهای چشمی.
تأثیر ساماریوم -۱۴۹ در کنترل راکتور از نظر مفهومی مشابه ۱۳۵Xe است. با این تفاوت که نوع ۱۴۹ دارای مقطع ضبط نوترون حرارتی بسیار بزرگ و در عین حال پایدار است. بنابراین با پوسیدگی رادیواکتیو به همان روشی که ۱۳۵Xe مصرف می شود، استفاده نمی گردد.
ساخت ضربه گیر های تک سیم پیچ بدون صدا با کاربرد خواص ساماریم کبالت مغناطیسی انجام می شود.
لیزرهای X-ray ساماریمی در رادیوگرافی کاربرد دارند.
استفاده در آلیاژ ها و هدفون ها
ترکیبات عنصر ساماریم
- فلوئورید ها: SmF۲، SmF۳
- کلرید ها: SmCl۲، SmCl۳
- برومید ها: SmBr۲، SmBr۳
- یدید ها: SmI۲، SmI۳
- اکسیدها: Sm۲O۳

خطرات عنصر ساماریم (ساماریوم)
عنصر ساماریم به طرق مختلف و عمدتا توسط صنایع مختلف در محیط پراکنده شده و به محیط زیست وارد می شود. بدین ترتیب عنصر ساماریوم به تدریج در خاک تجمع یافته و در نهایت غلظت آن در بدن انسان، جانوران و ذرات خاک افزایش می یابد. این افزایش در مقدار این ماده می تواند باعث بروز آسیب هایی به بدن شود.
در جانوران آبزی ساماریم باعث آسیب غشای سلولی می شود که روی تولید مثل و عملکرد سیستم عصبی اثر منفی دارد.
نمک های محلول در ساماریم به دلیل بلع خفیف سمی هستند و خطرات سلامتی مرتبط با آن ها وجود دارد. قرار گرفتن در معرض ساماریوم باعث تحریک پوست و چشم می شود. کاربرد و خواص عنصر ساماریم معمولا خطری برای گیاهان و حیوانات ایجاد نمی کند.
تمام ترکیبات عنصر ساماریوم بسیار سمی هستند. و برای چشم و دست بسیار سوزشآور میباشند. غبار فلز این عنصر، آتشزا و قابل انفجار است.
سخن آخر
در جدول تناوبی مندلیف عناصر مختلفی قرار گرفته اند. این عناصر از لحاظ خواص فیزیکی و شیمیایی با یکدیگر متفاوتد. معمولا عناصری که در یک گروه از جدول تناوبی مندلیف قرار گرفته اند خواص مشابهی نیز دارند. برای شناخت عناصر می توان به جدول تناوبی مندلیف مراجعه نمود. در این جدول تمام عناصر جایگاه مخصوص به خود را دارا هستند. با شناخت بهتر عناصر جدول تناوبی می توان به کاربرد و ویژگی عناصر بهتر پی برد. کاربرد های صنعتی و سلامت و پزشکی و کشاورزی و… عناصر، تنها با شناخت کامل آن ها امکان پذیر است. دانشمندان همواره در تلاشند تا شناخت بیشتری از این عناصر یافته و اینگونه پیشرفت بشر کمک نمایند.
به دلیل اهمیت بالای این عناصر در زندگی روزمره و صنعت و همین طور آینده، نشریه علمی جهان شیمی فیزیک به توضیح و بررسی عناصر پرداخته است. برای آشنایی با خواص و کاربرد و تاریخچه عناصر شیمیایی جدول تناوبی می توانید به سایت نشریه علمی جهان شیمی فیزیک مراجعه کرده و اطلاعات خود در این زمینه را کامل کنید.



















