خواص عنصر پتاسیم چیست؟ کاربرد و ویژگی پتاسیم

عنصر پتاسیم از عناصر شیمیایی جدول تناوبی مندلیف بوده و با نماد شیمیایی K شناخته میشود. عدد اتمی عنصر پتاسیم ۱۹ و عدد جرمی آن ۳۹.۰۹۸ است. عنصر پتاسیم در گروه اول و تناوب چهارم از جدول تناوبی جای گرفته است. پتاسیم از فلزات قلیایی بوده و عنصری نرم به رنگ نقرهای سفید است. از خواص عنصر پتاسیم میتوان به این اشاره کرد که در هوا به راحتی اکسید می شود. از کاربرد عنصر پتاسیم می توان به تولید کود (پتاس) اشاره نمود. ویژگی عنصر پتاسیم تاثیرات بسزایی در رشد گیاهان دارد. لازم به ذکر است که ایزوتوپ عنصر پتاسیم شناخته شده است و در ادامه بررسی می گردد. ترکیبات عنصر پتاسیم نیز کاربرد های صنعتی، کشاورزی و… زیادی دارند که انواع نمک پتاسیم از آن جمله اند. در ادامه این مقاله خواص و کاربرد عنصر پتاسیم بررسی می گردد.
نشریه علمی جهان شیمی فیزیک به بررسی عناصر شیمیایی جدول تناوبی عناصر مندلیف پرداخته است. عناصری مانند: هیدروژن، لیتیم، بریلیوم، منیزیم و… . در ادامه با معرفی عنصر پتاسیم و کاربرد آن با ما همراه باشید.
پیشینه عنصر پتاسیم
۲.۴% از وزن پوسته زمین را پتاسیم تشکیل میدهد. این ماده هفتمین عنصر از لحاظ فراوانی در پوسته زمین بشمار می آید. این ماده در سال ۱۸۰۷ به عنوان یک عنصر شیمیایی به وسیله همفری دیوی کشف شد. این دانشمند آن را از پتاس (یک ترکیب عنصر پتاسیم ) جدا نمود. اولین فلزی که بهوسیله الکترولیز جداسازی شد، این ماده بود.
این عنصر را می توان در منابع مختلفی یافت. مواد معدنی حاوی این عنصر مانند Carnallite, Langbeinite, Polyhalite و Sylvite در بستر دریاها یا دریاچه های قدیمی یافته میشوند.
منابع مهم پتاسیم و پتاس در کالیفرنیا، آلمان، نیومکزیکو، یوتا و مناطق دیگر جهان وجود دارد. در عمق ۳۰۰۰ فوتی زیر بستر ساسکاچوان کانادا، مقادیر عظیمی از پتاس وجود دارد. این منابع میتواند در آینده مورد استفاده قرار گیرد.
از دیگر منابع پتاسیم اقیانوس ها می باشند. اما در اقیانوس ها مقدار پتاسیم موجود در یک حجم معین از آب دریا بسیار کمتر از سدیم است. عمل الکترولیز میتواند پتاسیم را به اجزای هیدروکسیدش تجزیه کند. روش های حرارتی از روش های دیگر تولید پتاسیم بشمار می آید. لازم به ذکر است که به دلیل خواص عنصر پتاسیم، این ماده هرگز به صورت رها شده در طبیعت یافت نمی شود. یون پتاسیم (K+) در ارگانیسم های زنده برای سلول های تحریکی بسیار ارزشمند هستند.
ویژگی عنصر پتاسیم عنصر شماره ۱۹ جدول تناوبی
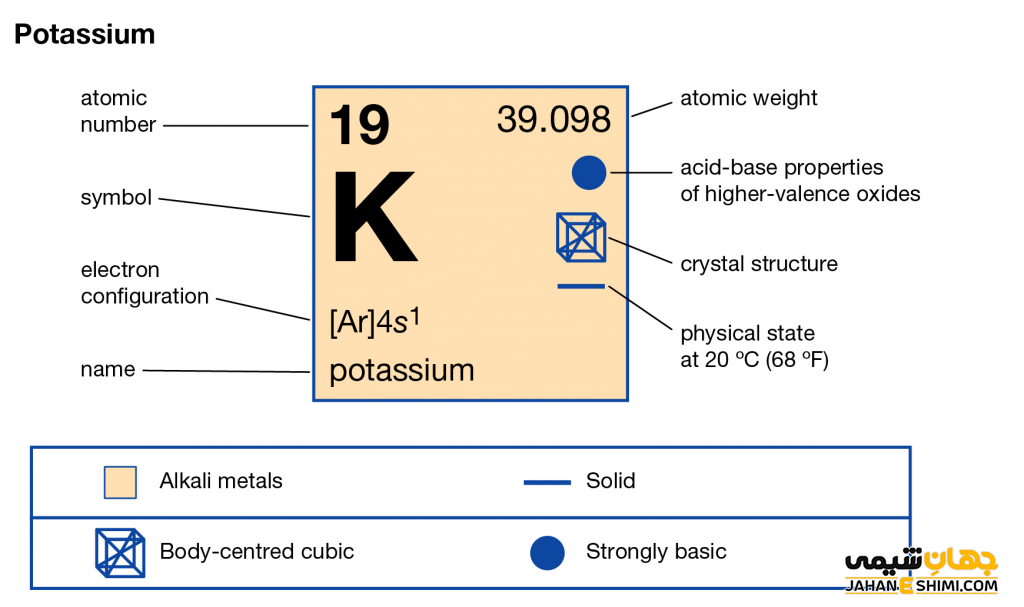
- نماد شیمیایی: K
- عدد اتمی: ۱۹
- گروه:۱، فلزات قلیایی
- دوره: ۴
- عدد جرمی: ۳۹.۰۹۸
- حالت فیزیکی: جامد
- چگالی در شرایط STP: 0.862 g/cm۳
- لایه الکترونی: ۲,۸,۸,۱
- آرایش الکترونی: [Ar] 1s۱
- نقطه ذوب: ۶۳.۳۸ درجه سانتی گراد
- نقطه جوش: ۷۵۹ درجه سانتی گراد
- الکترونگاتیویته: ۰.۸۲ (مقیاس پائولینگ)
- شعاع اتمی: ۲۲۷ pm
خواص عنصر پتاسیم
خواص عنصر پتاسیم عنصر شماره ۱۹ جدول تناوبی بسیار شبیه به سدیم است. اما میل ترکیبی بسیار بیشتری دارد. پتاسیم از دسته فلزات قلیایی بوده و بعد از لیتیم به عنوان سبکترین فلز شناخته می شود. از ویژگی عنصر پتاسیم می توان به نرم بودن آن اشاره کرد. این ماده به قدری نرم است که میتوان آن را با چاقو برید. نکته جالب این است که پس از بریده شدن در سطح برش، جلایی نقرهای به چشم می خورد. از دیگر خواص عنصر پتاسیم این است که یکی از واکنش دهنده ترین و پاسخ دهنده ترین فلزات نسبت به الکتریسته است. در معرض هوا قرار گرفتن پتاسیم موجب اکسید شدن آن می شود. بنابراین باید آن را درون روغن های معدنی مانند نفت سفید نگهداری نمود.
پتاسیم از دسته فلزات قلیایی بوده و مانند آن ها در آب با گرفتن هیدروژن از هم می پاشد. این ماده با رسیدن آب به طور خود به خودی آتش میگیرد. نمک پتاسیم به شعله ها رنگ بنفش ساطع می کند. این ماده دومین فلز سبک بشمار آمده و در بین فلزات واکنش پذیر ترین است. همچنین این ماده الکتروپوزیتیو ترین فلز بشمار می آید. لازم به ذکر است که این عنصر از عناصر گران قیمت بشمار می آید. برای آشنایی با خواص این ماده می توان به مدل اتمی بور برای عنصر پتاسیم مراجعه نمود.
انواع عنصر پتاسیم
- پتاسیم محلول: این نوع از این ماده در خاک به صورت محلول یونی وجود دارد و تنها نوعی از پتاسیم است که می تواند توسط گیاهان جذب گردد.
- پتاسیم تبادلی: این نوع از این ماده تحت شرایطی به آسانی توسط نمک های خنثی قابل استخراج است.
- پتاسیم ساختمانی: این انواع درواقع جزئی از شبکه کریستالی کانی ها بشمار می آیند.
- پتاسیم غیرتبادلی: این انواع به آسانی قابل تبادل نبوده و در زمان کوتاه توسط نمک های معدنی آزاد نمی شوند.
ایزوتوپ عنصر پتاسیم
از فلز قلیایی پتاسیم ۲۵ ایزوتوپ مختلف شناسایی شده است. این ایزوتوپ ها از ۳۲K تا ۵۶K را شامل میشوند. تنها ایزوتوپ عنصر پتاسیم که به طور طبیعی وجود دارند در ادامه آورده شده اند.
- ایزوتوپ ۳۹K با فراوانی ۹۳.۳%
- ایزوتوپ عنصر پتاسیم ۴۱K با فراوانی ۶.۷%
- ایزوتوپ پتاسیم ۴۰K با فروانی ۰.۰۱۲%
ایزوتوپ پتاسیم-۴۰ درواقع ایزوتوپ پرتوزا عنصر پتاسیم است. این عنصر دارای نیمه عمر بسیار بالایی است. همانطور که گفته شد این عنصر در حدود ۰.۰۱۲% از پتاسیم های موجود در طبیعت را شامل می شود. کاربرد ایزوتوپ عنصر پتاسیم در تاریخ گذاری پتاسیم و آرگون برای تشخیص سن آثار باستانی استفاده می شود.
کاربرد عنصر پتاسیم
اکسید پتاسیم که با نام پتاس شناخته شده است، در تولید انواع کود کشاورزی بکار میرود.
کاربرد نیترات پتاسیم که از ترکیبات این ماده است نیز در ساخت باروت مصرف دارد.
از خواص عنصر پتاسیم در ساخت شیشه استفاده میشود.
از آلیاژ سدیم و پتاسیم به عنوان رسانا انتقال گرما استفاده میشود.
ماده بنیادی برای رشد گیاهان پتاسیم بوده و در انواع گوناگون خاک نیز یافت میشود.
در سلول های موجودات زنده مانند انسان یون پتاسیم از مواد حیاتی برای زنده نگه داشتن سلول ها است.
نمک های پتاسیم بسیار مهم هستند. برمید پتاسیم، کربنات پتاسیم، کلرات پتاسیم، کلرید پتاسیم، کرومات پتاسیم، سیانید پتاسیم، دیکرومات پتاسیم، هیدروکسید پتاسیم، یدید پتاسیم، نیترات پتاسیم و سولفات پتاسیم از آن جمله اند.
ترکیبات عنصر پتاسیم
پتاسیم هیدروکسید (پتاس)
پتاسیم هیدروکسید یا هیدروکسید پتاسیم یک ماده قلیایی است. این ماده به عنوان ترکیبی معدنی با فرمول شیمیایی KOH شناخته می شود. از این ماده با نام پتاس سوز آور نیز شناخته می شود. پتاسیم هیدروکسید یک ماده قوی بوده و به اشکال مختلفی از جمله قرص و پودر در بازار خرید و فروش عرضه می شود. در صنایع مختلف شیمیایی، صنعتی و ساختمانی کاربرد های آن شناخته شده است. از پتاسیم هیدروکسید به عنوان ترکیب مقدماتی در سایر ترکیبات پتاسیم استفاده می شود. کاربرد این ماده در مواد غذایی نیز دیده می شود. برای تنظیم pH، به عنوان تثبیت کننده و به عنوان ماده سفت کننده از آن استفاده می گردد.
- از پتاسیم هیدروکسید به عنوان ماده ای قلیایی برای خنثی کردن اسیدیته و تنظیم pH محلول ها استفاده می شود.
- یک عامل با ارزش برای تیتراسیون اسیدها و تعیین غلظت آن در تجزیه و تحلیل های شیمیایی به شمار می آید.
- این ماده برای شستن میوه در کارخانه ها استفاده می شود.
- برای پوست کندن میوه و سبزیجات از پتاسیم هیدروکسید استفاده می شود.
- از این ماده برای تولید رنگ کارامل نیز استفاده می شود.
- پتاسیم هیدروکسید در تولید نوشابه، شکلات و کاکائو کاربرد دارد.
- این ماده به نرم شدن زیتون ها کمک می کند.
- این ماده باعث ترد شدن چوب شور ها نیز می شود.
خواص عنصر پتاسیم در بدن
یک از یون هایی که در بدن وجود دارد، یون پتاسیم است. تغییرات جزئی در مقدار آن میتواند مشکلات عصبی و قلبی ایجاد کند. سطح این یون در خون به دقت تنظیم میشود. پتاسیم، در پلاسمای خون نسبتاً در سطح پائینی قرار دارد. ولی درون سلول ها تجمع زیادی داشته و سطوح پائین آن در خون هیبوکالمی و سطوح بالای آن هایپرکالمی نام دارد. هر دو مورد یعنی چه سطح پائین چه سطح بالای این ماده برای قلب ضرر داشته و بسیار خطر آفرین است.
علائم کمبود پتاسیم در بدن
- بروز خستگی
- خواب آلودگی
- ضعف عضلانی
- ایجاد یبوست
- بروز نامنظمی ضربان قلب
- بروز تاخیر در تخلیه معده

منابع غذایی پتاسیم
آرد سویا، لوبیا سفید، عدس، موز و اسفناج و… .
کاربرد کود عنصر پتاسیم
به دلیل ویژگی و خواص عنصر پتاسیم و فعالیت بالایش، این ماده در حالت خالص در طبیعت یافت نمیشود. نوع خالص این ماده باید در روغن مخصوصی نگهداری شود تا خالص باقی مانده و از واکنش های شدید محافظت شود. ذخایر پتاس در طبیعت به شکل صفحات نمکی جامد در زیر پوسته سطح زمین و زیر دریا ها و دریاچه های در حال نابودی یافت میشوند.
از پتاسیم هیدروکسید برای تولید کود های تامین کننده عنصر پتاسیم برای محصولات زراعی استفاده می شود. زیرا این ماده یکی از اصلی ترین منابع تغذیه گیاهان بشمار می آید. این ماده بخصوص برای محصولاتی که قادر به تحمل یون های کلرید نیستند، بسیار کاربرد خواهد داشت.
مضرات عنصر پتاسیم در صورت کمبود در گیاهان
کمبود عنصر پتاسیم در گیاهان در ابتدا منجر به بروز علائم ظاهری و نشانه های قابل دیدن نمیشود. ابتدا میزان رشد و عملکرد گیاه کاهش می یابد. این اتفاق اصطلاحاً گرسنگی پنهان نامیده می شود. تا زمانی که کمبود پتاسیم شدید نباشد، حتی تا پایان فصل رشد نیز علائم ظاهری بروز نکرده اما کاهش عملکرد در این شرایط قطعی است. نشانه های ظاهری کمبود پتاسیم ابتدا بر روی دومین و سومین برگ های پیرتر گیاه ظاهر میشود. در پیرترین برگ ها اغلب زردی و سوختگی از نوک و حاشیه برگها شروع شده و توسعه پیدا میکند. بالا بودن بیش از حد غلظت پتاسیم نیز باعث ایجاد اختلال در جذب روی و آهن و منگنز در گیاه خواهد شد.
مزایا و خواص کاربرد عنصر پتاسیم برای گیاهان
- رشد ریشه را افزایش داده و تحمل در برابر خشکی را بهبود میبخشد.
- حداقل ۶۰ نوع آنزیم مؤثر در رشد را فعال میسازد.
- در فرآیند فتوسنتز و تولید غذا نقش بسزایی دارد.
- در انتقال قند ها و نشاسته ها کمک میکند.
- تولید دانه هایی با نشاسته زیاد را موجب خواهد شد.
- بر افزایش میزان پروتئین موجود در گیاه موثر است.
- باعث حفظ آماس گیاهی شده و کمبود آب و پلاسیدگی گیاه را کاهش میدهد.
- از گسترش بیماری های گیاهی جلوگیری میکند.
احتیاط مصرف
مصرف زیاد این ماده برای افراد سالمند و کسانی که به اختلالات کلیوی دچارند چندان مناسب نیست.
این ماده بر تعادل مایعات در بدن تاثیر می گذارد.
با افزایش سن کلیه ها کمتر قادر به حذف پتاسیم از خون خواهند بود. بنابراین از دریافت بدون نسخه هرگونه مکمل پتاسیم باید با پزشک مربوطه مشورت شود.
هشدار کاربرد عنصر پتاسیم
این ماده خطر آتشسوزی دارد. این ماده با آب واکنش می دهد و این عمل نیز گرما زا است. گرمای حاصل از این عمل پتاسیم را ذوب و پراکنده کرده و هیدروژن را آتش میزند.
از طرفی خاموش کردن آتشسوزی ناشی از پتاسیم نیز مشکل است. برای خاموش کردن آن گرد خشک خاکستر سودا یا گرافیت یا مخلوط های مخصوصی از مواد شیمیایی خشک استفاده می شود.
این ماده قادر است خود به خود در هوای مرطوب آتش بگیرد.
در واکنش های شیمیایی نیز خطر نسبی انفجار وجود دارد.
فلز پتاسیم حتی اگر در زیر روغن های معدنی انبار شده باشد نیز میتواند در دمای اتاق پراکسید و سوپر اکسید تشکیل دهد و وقتی حمل می شود اگر پاره شود ممکن است به شدت منفجر شود.
این ماده در جو های بی اثر مانند آرگون و نیتروژن یا در مایعاتی که اکسیژن جذب نمیکنند مانند تولوئن یا کروزن (نفت سفید) نگهداری می شود.
همچنین این فلز را می توان در کپسول های شیشه ای نگهداری نمود که در خلا یا جو بی اثر پر میشوند.

عوارض کمبود پتاسیم در بدن
پتاسیم یکی از الکترولیت های اصلی بدن است. نقش مهمی در عملکرد طبیعی سلول ها و فعالیت های حیاتی بدن از جمله سلامت اعصاب، ماهیچه ها و استخوان ها، عملکرد قلب و سیستم گوارشی سالم دارد. بدن پتاسیم را با جذب آن از غذا در دستگاه گوارش به دست می آورد. کلیه ها پتاسیم اضافی را از طریق ادرار از بدن خارج می کنند. این باعث حفظ سطح طبیعی پتاسیم خون می شود. هیپوکالمی (سطح پایین پتاسیم خون) یا هیپرکالمی (پتاسیم بیش از حد در بدن) می تواند خطرناک باشد. افراد مبتلا به هیپوکالمی (سطح پایین پتاسیم خون) ممکن است علائم و نشانه هایی مانند خستگی، یبوست، تپش قلب، ضعف عضلانی، گزگز و بی حسی را تجربه کنند. سطوح پایین پتاسیم به شدت می تواند باعث ایجاد ریتم نامنظم قلب شود.
خوردن غذاهای غنی از پتاسیم و مصرف مکمل های خوراکی پتاسیم می تواند کمبود پتاسیم را اصلاح کند. با این حال، شما باید مکمل پتاسیم را فقط در صورت توصیه پزشک مصرف کنید، به خصوص اگر بیماری کلیوی یا مشکلات قلبی دارید. با مصرف مکمل پتاسیم می توانید پتاسیم اضافی دریافت کنید. پتاسیم همچنین در بسیاری از مولتی ویتامین ها و مکمل های معدنی موجود است. افرادی که سطح پتاسیم بسیار پایینی دارند می توانند ریتم قلب نامنظم را تجربه کنند. بنابراین، کاهش قابل توجه سطح پتاسیم ممکن است بستری شدن در بیمارستان برای انفوزیون داخل وریدی کلرید پتاسیم را ضروری کند. این ممکن است برای حفظ عملکرد صحیح قلب و کاهش خطر ضربان قلب نامنظم مرتبط با هیپوکالمی ضروری باشد.
- حمله قلبی یا ناهنجاری های ریتم: پتاسیم بسیار پایین باعث تاکی کاردی بطنی، بلوک قلبی و آسیستول می شود.
- نارسایی تنفسی: ضعف تنفسی عصبی عضلانی تنفس را مختل می کند و نیاز به حمایت شدید ونتیلاتور دارد.
- فلج: هیپوکالمی شدید و درمان نشده اندام ها و ماهیچه های تنفسی را فلج می کند و خطر ناتوانی عمیق را به دنبال دارد.
سخن آخر
در این مقاله به معرفی یکی از عناصر جدول تناوبی مندلیف پرداخته شد. عناصر شیمیایی خواص و مزایای گوناگونی دارند و علاوه بر مزایا می توانند خطراتی را نیز به دنبال داشته باشند. این علم و توانایی بشر است که بتواند کاربرد و خواص مفید عناصر را بشناسد و در راه پیشرفت صنعت و سلامت بشر به کار گیرد. خواص عناصر مختلف متفاوت بوده و بنابراین هر یک از این عناصر را می توان برای اهداف خاصی استفاده نمود.




















یک دیدگاه