
در علم شیمی، واکنش های شیمیایی (Chemical reactions) به فرآیند هایی گفته می شود که در طی آنها، یک یا چند ماده اولیه به عنوان واکنشگر (یا واکنش دهنده) به یک یا چند ماده جدید که محصولات (یا فرآورده) نام دارند، تبدیل می شوند. توجه داشته باشید که محصولات تولید شده در طی یک واکنش اغلب با واکنشگر ها متفاوت می باشند. در مطالب پیشین نشریه جهان شیمی فیزیک، با مفهوم واکنش شیمیایی و چگونگی انجام آن ها آشنا شده اید. در این مقاله به بررسی انواع واکنش های شیمیایی پرداخته می شود. لطفا همراهی بفرمایید.
انواع واکنش های شیمیایی
واکنش های شیمیایی زیادی تا به امروز شناخته شده اند، بنابراین دسته بندی های مختلفی نیز برای این واکنش ها وجود دارد. البته توجه داشته باشید که گاهی این دسته بندی ها با یکدیگر نیز همپوشانی دارند. اما بر طبق یک تقسیم بندی اساسی، انواع واکنش های شیمیایی را به پنج دسته اصلی تقسیم می کنند. لازم به ذکر است که بقیه واکنش ها به قسمی زیر مجموعه این پنج دسته اصلی قرار می گیرند. بنابراین انواع واکنش های شیمیایی عبارتند از :
- واکنش های شیمیایی سوختن یا احتراق (Combustion reaction)
- واکنش های شیمیایی ترکیبی یا سنتز (Combination reactions)
- واکنش های شیمیایی تجزیه ای یا انالیز (Decomposition reactions)
- واکنش های شیمیایی جانشینی یگانه (Single-Replacement reactions)
- واکنش های شیمیایی جانشینی دوگانه (Double-Replacement reactions)
با بررسی، تجزیه و تحلیل واکنشگر ها و محصولات یک واکنش، می توان واکنش مورد نظر را در یکی از گروه های بالا قرار داد. همانطور که بیان شد تعدادی از واکنش ها در بیش از یک گروه قرار می گیرند. در ادامه مقاله به بررسی انواع واکنش های شیمیایی خواهیم پرداخت.
واکنش های شیمیایی سوختن یا احتراق پایه هشتم
به واکنش سریع و با شدت مواد با اکسیژن، سوختن می گویند. این واکنش با آزاد شدن انرژی به صورت نور و گرما همراه است و در اغلب آنها، ترکیبات اکسیژن دار بوجود می آید. لازم به ذکر است که هنوز هم از واکنش های سوختن برای تامین انرژی مورد نیاز، استفاده می کنند. زیرا در حقیقت سوخت های فسیلی جز ارزان ترین و اصلی ترین منابع تولید انرژی محسوب می شوند. به عبارت دیگر، تمامی واکنش های احتراق، گرماده می باشند. توجه داشته باشید که نمی توان واژه سوختن را برای هر واکنشی که با اکسیژن انجام می شود، بکار برد. در واقع اگر یک ماده به آرامی با اکسیژن ترکیب شود و همچنین گرما یا نور زیادی تولید نشود، این واکنش دیگر سوختن نیست و اکسایش نام دارد. همانند واکنش زنگ زدن آهن.
بسیاری از واکنش های سوختن با هیدروکربن ها انجام می شود. محصول سوختن هیدروکربن ها همیشه دی اکسید کربن و آب می باشد. تعداد زیادی از این هیدروکربن ها به عنوان سوخت کاربرد دارند، زیرا با سوختن آنها مقدار قابل توجه ای انرژی گرمایی آزاد می شود.
گاز اکسیژن + هیدرو کربن → انرژی + آب + دی اکسید کربن
لازم به ذکر است که اگر احتراق هیدرو کربن ها کامل نباشد، در بخش محصولات، به جای گاز دی اکسید کربن، دوده و مونو اکسید کربن تولید خواهد شد. دقت داشته باشید که از آن جایی که واکنش های احتراق به صورت انفجاری اند و بنابراین با گرمای زیادی همراه می باشند، پس آب تولید شده از این واکنش ها به صورت گاز شکل است نه مایع.

علاوه بر سوختن هیدروکربن ها، واکنش فلزات قلیایی و قلیایی خاکی (به استثنای Be) نیز همراه با آزاد کردن گرما و نور شدید می باشد. در واقع از سوختن فلزات، اکسید فلزی یا اکسید بازی تولید می شود، زیرا هنگام واکنش این اکسید های فلزی با آب، باز تولید می گردد. به طور مشابه، با سوختن نافلزات، اکسید نافلزی یا اکسید اسیدی تولید می شود. زیرا هنگام واکنش این اکسید های نافلزی با آب، اسید تولید می گردد. توجه داشته باشید که فلزاتی همچون سدیم، پتاسیم، کلسیم و منیزیم زمانی که با اکسیژن واکنش سریع دهند و همزمان گرما و نور تولید کنند، واکنش از نوع سوختن خواهد بود. در غیر اینصورت اگر به آرامی با اکسیژن واکنش دهند، واکنش اکسایش می باشد.
به عنوان یک نکته کنکوری در نظر داشته باشید که محصولات حاصل از سوختن کامل را می توان بر مبنای عناصر تشکیل دهنده ترکیب مورد نظر پیش بینی کرد. در واقع اگر ترکیبی شامل
- کربن باشد، گاز دی اکسید کربن (CO۲) تولید می شود.
- هیدروژن باشد، آب (H۲O) تولید می شود.
- گوگرد باشد، گاز دی اکسید گوگرد (SO۲) تولید می شود.
- نیتروژن باشد، گاز نیتروز اکسید (N۲O) تولید می شود.
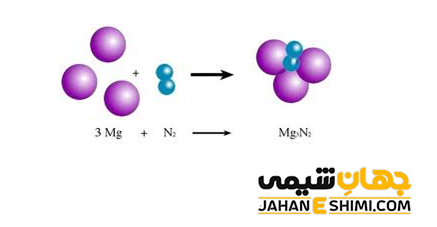
واکنش های شیمیایی ترکیبی یا سنتز
در این نوع واکنش، دو یا چند عنصر یا ترکیب شیمیایی با یکدیگر واکنش داده و محصول جدید و پیچیده ای در اثر تشکیل پیوند میان آنها تولید می شود. به عبارت دیگر، دو عنصر با یکدیگر پیوند می دهند و یک ترکیب جدید تشکیل می شود. فرم کلی واکنش سنتز به صورت زیر می باشد.
A + B → AB

به عنوان مثال، واکنش تولید آمونیاک یک واکنش سنتزی می باشد. در این نوع از واکنش ها، دسته بندی های متفاوتی قرار می گیرند که انواع واکنش های شیمیایی ترکیب عبارتند از :
۱- واکنش ترکیبی میان یک نافلز و اکسیژن؛ در اثر این واکنش، اکسید نافلزی تولید می شود. همانطور که بیان شد اگر این اکسید نافلزی با آب واکنش دهد، اسید تولید می گردد.
اکسید نافلزی → نافلز + اکسیژن
اسید اکسیژن دار → اکسید نافلزی + آب
۲- واکنش ترکیبی میان یک فلز و اکسیژن؛ در اثر این واکنش، اکسید فلزی تولید می شود. همانطور که بیان شد اگر این اکسید فلزی با آب واکنش دهد، باز یا قلیا تولید می گردد.
اکسید فلزی → فلز + اکسیژن
باز→ اکسید فلزی + آب
۳- واکنش های خنثی شدن؛ توجه داشته باشید که این واکنش خود به چند دسته مختلف تقسیم می شود که عبارتند از :
۱-۳- واکنش میان یک اکسید فلزی و یک اکسید نافلزی، در اثر این واکنش نمک تولید می شود نه آب.
Na۲O۲ + SO۲ → Na۲SO۳
۲-۳- واکنش میان آمونیاک و هالید هیدروژن، این واکنش که منجر به تولید هالید آمونیوم می شود.
NH۳ + HCl → NH۴Cl
۳-۳- واکنش میان اسید و آمونیاک،
NH۳ + H۲SO۴ → (NH۴)۲ SO۴
۴- واکنش های بسپارش یا پلیمری؛ در این نوع از واکنش ها، هزاران مولکول کوچک با یکدیگر ترکیب شده و مولکول های بسیار بزرگی به نام پلیمر یا بسپار تولید می کنند.
۵- واکنش های فوتوسنتز؛ در این نوع از واکنش ها، از ترکیب آب و گاز دی اکسید کربن و در حقیقت با کمک نور خورشید، قند و اکسیژن تولید می گردد.
۶CO۲ (g) + 6H۲O (g) → C۶H۱۲O۶ (aq) + 6O۲ (g)
واکنش های شیمیایی تجزیه ای
در این نوع از واکنش، یک ترکیب شیمیایی به عناصر سازنده یا ترکیبات ساده تر تجزیه می شود. به عبارت دیگر، در یک واکنش تجزیه شیمیایی یا آنالیز، ترکیب مورد نظر به دو با چند جز شکسته می شود. برای انجام این واکنش به انرژی اولیه مثل گرما، نور یا برق نیاز است. فرم کلی واکنش تجزیه ای به صورت زیر می باشد.
AB → A + B

بنابراین اگر واکنشی به شما داده شد که در سمت چپ آن، یعنی سمت واکنش دهنده ها، تنها یک ماده شیمیایی وجود داشت، می توانید خیلی سریع بگویید که از واکنش از نوع تجزیه ای می باشد. به عنوان مثال می توان به تجزیه آب به هیدروژن و اکسیژن اشاره کرد. در این نوع از واکنش ها، دسته بندی های متفاوتی قرار می گیرند که انواع واکنش های شیمیایی تجزیه ای عبارتند از :
۱- آبکافت یا هیدرولیز؛ در این واکنش، با کمک آب یک ماده شیمیایی به چند ماده سادهتر تبدیل می شود.
۲- برقکافت یا الکترولیز؛ برقکافت نیز یک فرآیند تجزیه ای محسوب می شود که طی آن، یک ترکیب با کمک انرژی الکتریکی، به عناصر اولیه تبدیل می شود.
۳- با کمک گرما؛ در این از واکنش ها در اثر حرارت دادن، می توان ترکیب را به ترکیبات ساده تر تبدیل کرد.
از جمله واکنش های تجزیه ای می توان به تجزیه کربنات فلزات، تجزیه بی کربنات فلزات (هیدروژن کربنات فلزات)، تجزیه نیترات فلزات، تجزیه کلرات فلزات، تجزیه سولفات فلزات و همچنین تجزیه الکتریکی نمک مذاب اشاره کرد.
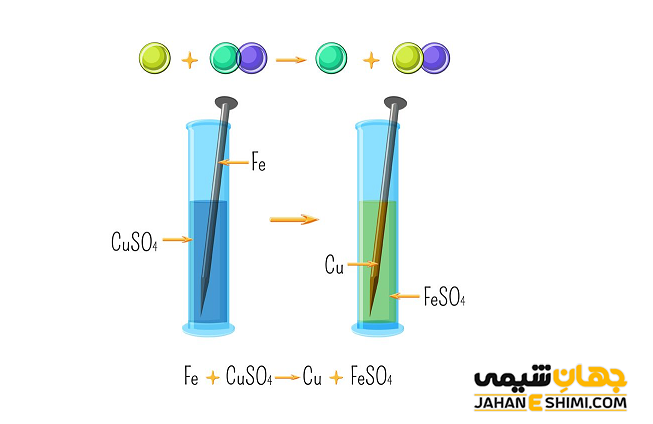
واکنش های شیمیایی جانشینی یگانه
زمانیکه در یک ترکیب شیمیایی، یک عنصر با واکنش پذیری بالاتر جایگزین عنصر دیگری در ترکیب مورد نظر شود، واکنش جابهجایی یا جانشینی یگانه انجام شده است. به عبارت دیگر در این نوع از واکنش ها، یک عنصر جایگزین عنصر مشابه خود در یک ترکیب می شود. مثلا وقتی که عنصر مورد نظر یک فلز باشد، بایستی جایگزین یک فلز دیگر یا هیدروژن گردد. اما زمانیکه عنصر مورد نظر یک نافلز باشد، بایستی حتما جایگزین یک نافلز دیگر شود. فرم کلی واکنش جایگزینی یگانه به صورت زیر می باشد که در آن واکنش، عنصر A جایگزین عنصر B در ترکیب شده است.
A + BC → AC + B

از جمله واکنش های جانشینی یگانه می توان به جانشینی یک فلز در یک ترکیب با یک فلز فعال تر، جانشینی یک نافلز در یک ترکیب با یک نافلز فعال تر، جانشینی هیدروژن اسید با یک فلز فعال بالای هیدروژن در سری الکتروشیمیایی و همچنین واکنش فلزات قلیایی و قلیایی خاکی با آب (به استثنای Be) اشاره کرد. در واقع، بریلیوم تنها عنصر قلیایی خاکی می باشد که با آب یا بخار آب داغ واکنشی نمی دهد.
توجه داشته باشید که واکنش های جانشینی یگانه ای که قرار است دو هالوژن با یکدیگر جابه جا شوند، همیشه انجام نمی شوند. زیرا این واکنش ها تنها زمانی رخ می دهند که هالوژن بالاتر در جدول تناوبی (به غیر از فلوئور) می تواند جای هالوژن پایین تر را در ترکیب نمک آن بگیرد. اما عکس این قضیه صادق نمی باشد. به بیان دیگر، هالوژن پایینی، در مقابل هالوژن بالاتر بی اثر می باشد. مثلا واکنش زیر انجام نمی شود.
I۲ + ۲NaCl → انجام ناپذیر
نکته
علت شرکت نکردن فلور در این دسته واکنش ها به این دلیل است که واکنش پذیری فلور با آب بسیار شدید می باشد. همانطور که می دانید، این واکنش ها نیز در محیط آبی انجام می شوند، پس فلوئور پیش از آنکه بتواند هالوژن پایینتر از خود را از واکنش خارج کند، با آب وارد واکنش می شود.
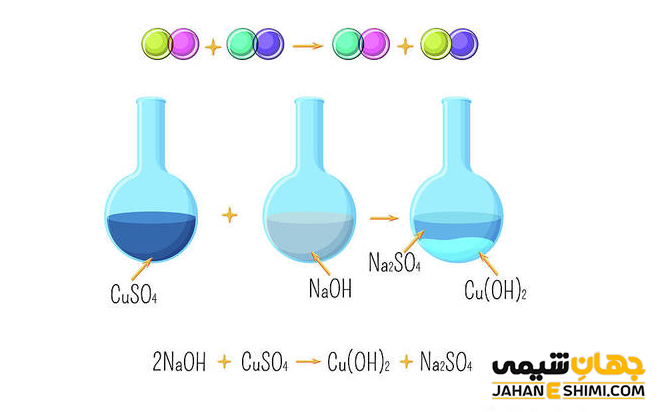
واکنش های شیمیایی جانشینی دوگانه
زمانیکه پیوند های دو ترکیب یا یون ها، جهت تولید ترکیبات مختلف جابه جا شوند، واکنش جابهجایی یا جانشینی دوگانه انجام شده است. در واقع در این نوع واکنش، جای دو اتم یا یون ها در دو ماده با یکدیگر عوض می شود. به عبارت دیگر واکنش جانشینی دوگانه به واکنشی گفته می شود که در طی آن، یون های مثبت و منفی دو ترکیب یونی جایگزین یکدیگر شوند و در نتیجه دو محصول جدید تولید گردد. فرم کلی این واکنش به صورت زیر می باشد که در آن، A و C در حقیقت کاتیون هایی با بار مثبت، B و D نیز آنیون هایی با بار منفی می باشند.
AB + CD → AD + CB

به طور کلی می توان گفت که یک واکنش جانشینی دوگانه، میان دو جز در محلول آبی رخ می دهد. معمولا برای انجام این واکنش، یکی از محصولات می تواند رسوب جامد، گاز و یا یک ترکیب مولکولی مثل آب باشد. توجه داشته باشید که تشکیل یک محصول همراه با تجزیه آن نیز می تواند در این دسته از واکنش ها قرار گیرد. مانند واکنش زیر :
CaCO۳ + HCl → CaCl۲ + CO۲ + H۲O
تفاوت واکنش جانشینی دوگانه با واکنش جانشینی یگانه در اینست که در واکنش های جانشینی یگانه، در سمت چپ واکنش (قسمت واکنش دهنده ها)، یکی از مواد به شکل عنصر آزاد و یا یون می باشد. در حالیکه، در واکنش جانشینی دوگانه، تمامی مواد سمت چپ واکنش، به شکل ترکیبات چند اتمی اند.
واکنش های شیمیایی اسید و باز
به واکنشی که میان اسید ها و باز ها انجام می شود، واکنش اسید و باز می گویند. توجه داشته باشید که این نوع از واکنش ها، با توجه به مفهوم اسید و باز بکار گرفته شده (تعریف آرنیوس، تعریف برونستد-لوری و تعریف لوویس)، تعاریف متفاوتی می تواند داشته باشد.
واکنش شیمیایی اکسایش-کاهش
واکنش هایی که در طی آنها، عدد اکسایش اتم های درگیر در واکنش تغییر کند را واکنش اکسایش- کاهش می نامند. در این واکنش ها در واقع، یک یا چند الکترون از اتم ها، مولکول ها یا یون ها به سایر اتم ها، مولکول ها یا یون ها منتقل می شود. دقت کنید که در هر واکنش اکسایش و کاهش، زمانیکه یک عنصر، الکترون از دست بدهد، اکسایش و زمانیکه یک عنصر الکترون بگیرد، کاهش می یابد.
انواع واکنش های شیمیایی شیمی دهم
واکنش شیمیایی فرآیندی است که در آن پیوندهای درون مولکول های واکنش دهنده به منظور تشکیل یک ماده جدید شکسته می شوند. این را می توان در یک واکنش شیمیایی به عنوان تغییر حالت، تغییر رنگ، تکامل گاز و تغییر دما مشاهده کرد. تغییرات در واکنش شیمیایی را می توان به عنوان تغییرات فیزیکی یا شیمیایی طبقه بندی کرد و شرح دقیق آن به شرح زیر است:
تغییر فیزیکی: زمانی که یک تغییر معمولاً برگشت پذیر در خواص فیزیکی یک ماده، از نظر اندازه یا شکل، رخ می دهد.
تغییر شیمیایی: هنگامی که یک خاصیت شیمیایی ماده تغییر می کند، نوعی تغییر شیمیایی است، مانند تغییر چگالی، تغییر دما، تغییر انرژی و غیره که معمولاً به آن واکنش شیمیایی می گویند.
چهار نوع اساسی از واکنش های شیمیایی در شیمی شناخته شده است: سنتز، تجزیه، جانشینی منفرد و جانشینی دوگانه. واکنش های سنتز شامل ترکیب دو یا چند واکنش دهنده برای تشکیل یک محصول جدید است. واکنش های تجزیه مستلزم تجزیه یک ترکیب به مواد ساده تر است. واکنش های جایگزینی منفرد زمانی رخ می دهند که یک عنصر دیگر را در یک ترکیب جابجا کند، در حالی که واکنش های جایگزینی مضاعف شامل تبادل اجزا بین دو ترکیب است. علاوه بر این، واکنشهای احتراق، که گرمازا هستند و شامل واکنش سوخت با اکسیژن است، نیز نوع مهمی از واکنش هستند.
یک واکنش تک جایگزینی یک عنصر را با عنصر دیگری در یک ترکیب جایگزین می کند.
جدول تناوبی یا یک سری فعالیت می تواند به پیش بینی اینکه آیا یک واکنش تک جایگزینی رخ می دهد یا خیر کمک کند.
یک واکنش دو جایگزینی، کاتیونها (یا آنیون های) دو ترکیب یونی را مبادله می کند.
واکنش رسوبی یک واکنش دو جایگزینی است که در آن یک محصول یک رسوب جامد است.
قوانین حلالیت برای پیش بینی اینکه آیا برخی از واکنش های جایگزینی مضاعف رخ خواهند داد یا خیر استفاده می شود.



















