گرماسنجی یا کالریمتری چیست؟ کاربرد دستگاه کالریمتر (قیمت خرید و فروش)

دستگاه کالریمتر آزمایشگاهی وسیله ای است که از آن در اندازه گیری میزان گرمای مبادله شده در واکنش های مختلف شیمیایی و فیزیکی و تعیین ظرفیت گرمایی ویژه مواد مختلف استفاده می شود. ریشه لغت کالریمتر از واژه یونانی کالر به معنی گرما در زبان لاتین است. کالریمترها انواع مختلفی از جمله کالری مترهای هم دما یا ایزوترمال، کالری مترهای اسکن تفاضلی، سنجش حجمی یا تیتراسیون و کالری مترهای افزایش دهنده آهنگ واکنش، دارند که این موارد نام برده از معمول ترین انواع کالری مترها هستند. در این مقاله نشریه جهان شیمی فیزیک دستگاه کالریمتر مورد بررسی و ارزیابی قرار می گیرد.
دستگاه کالریمتر آزمایشگاهی چیست؟
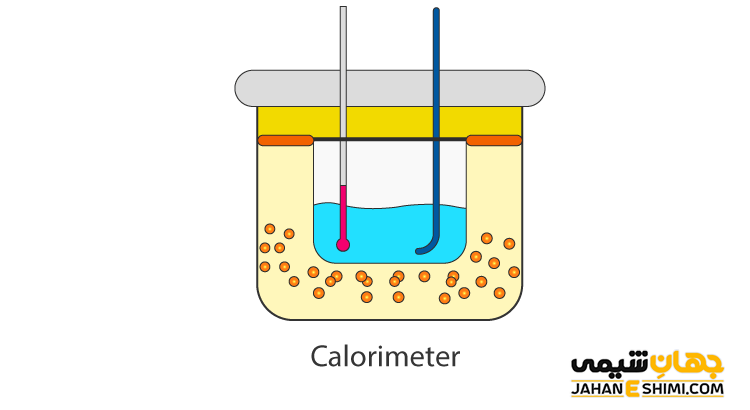
کالریمترها دستگاه هایی هستند که از آن ها برای سنجش میزان گرمای واکنش های مختلف استفاده می کنند. این دستگاه دارای یک مخزن استوانه ای شکل، دماسنج، هم زن و یک درپوش عایق است. نحوه محاسبه گرمای مبادله شده توسط این دستگاه به این صورت است که مقداری از دو ماده ای که قرار است بینشان مبادله دما انجام بگیرد را در ظرف می ریزیم و میزان تغییرات دما بین این دو را می سنجیم، با وجود این که در پوش های این دستگاه عایق می باشند، مقداری از گرما هدر می رود، به همین دلیل عددی به نام ارزش آبی برای این دستگاه وجود دارد که تأثیر گرمای کالری متر در واکنش را تعیین می کند.
انواع کالریمتر
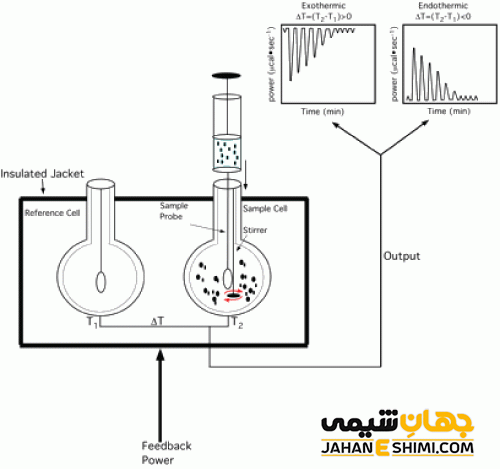
کالریمترهای اسکن تفاضلی، ایزوترمال، سنجش حجمی (تیتراسیون)، افزایش دهنده آهنگ واکنش و کالریمترهای ساده ای که دارای دماسنجی که به یک ظرف فلزی پر آب متصل بوده و زیر آن محفظه احتراق قرار دارد، انواع مختلف کالریمترها هستند. از لحاظ اندازه گیری نیز کالریمترها را به دو نوع هم دما یا ایزوترم و غیر هم دما تقسیم می کنیم. یکی از انواع کالری مترهای هم دما کالریمتر یخی است، این دستگاه در درجه حرارت مشخصی، تغییرات فازی ایجاد شده در اثر جذب انرژی را اندازه می گیرد. کالریمترهای غیر هم دما به دو صورت بی دررو (آدیاباتیک) و با درجه حرارت محیط ثابت استفاده می شوند، این دستگاه به وسیله تغییرات درجه حرارت، میزان انرژی جذب شده را اندازه گیری می کند.
کالریمترهای هم دما
مخلوط آب و یخی که به وسیله پوششی از محیط اطراف جدا شده است، می تواند تا حدود C4-10 درجه میزان حرارت ثابتی را ایجاد کند. از زمان های قدیم کالریمترهای هم دما به منظور اندازه گرفتن فرایند های حرارتی که طولانی مدت بودند، استفاده می شد. در این دستگاه ها مخلوط آب و یخ که هیچ داد و ستد حرارتی با پوشش حرارتی ندارد، ماده ای است که انرژی را جذب می کند و با این کار مقداری از یخ را به آب تبدیل کرده و موجب تغییرحجم یخ موجود در دستگاه می شود. در صورتی که ماده جاذب انرژی یعنی مخلوط آب و یخ در تعادل ترمودینامیکی با یکدیگر باشند، تغییر حالت یخ و تبدیل آن به آب، با انرژی که در میان مولکول های مخلوط آب و یخ توزیع شده است، متناسب خواهد بود. در اندازه گیری های میکروکالریمتری نمی توان از این دستگاه ها استفاده کرد.
کالریمترهای غیر هم دما
با توجه به حرارت محیط ثابت
درون ظرف یا پوششی که دمای ثابتی دارد، ماده جذب کننده انرژی را قرار می دهیم، این نوع کالریمترها در اندازه گیری های حرارتی کوتاه مدت و با تندی ثابت کاربرد بیشتری دارند و ما می توانیم از طریق قوانین شار انرژی مقدار انرژی که بین پوشش و ماده جاذب مبادله می شود را حساب کنیم. ماده جاذب در این نوع دستگاه ها معمولا مخلوط آب و یخ است.
کالریمترهای بی دررو
در صورتی که دما و درجه حرارت جسم و محیط اطرافش یکسان بوده و با محیط اطراف هیچگونه داد و ستد انرژی نداشته باشد، می گوییم جسم دارای تعادل بی دررو است. به طور کلی اگر در یک دستگاه کالریمتری میزان تغییر دما در اثر اتلاف حرارت در مقابل درجه حرارتی که می توانیم اندازه گیری کنیم ناچیز باشد، می گوییم سیستم بی دررو است. در این سیستم ماده جاذب یا عنصر حرارتی که دوز جذب را در آن اندازه گیری می کنیم، با پوشش خاصی احاطه می شود. در انواع کالریمتر ها با نحوه کار متفاوت، در قسمت های مختلفشان ابزارهایی از جمله حفاظ های وسیله های حساس به حرارت (ترمیستر یا ترموکوپل)، عنصر حرارتی، گرم کن الکتریکی و عناصر حرارتی نصب می شود. بنابراین ماده جاذب و پوشش اطرافش درجه حرارت یکسانی خواهند داشت. این سیستم و مکانیسم ها از هدر رفت انرژی حرارتی جلوگیری می کنند ولی نمی توانند مقدار کم هدر رفت را محاسبه کنند.
کالریمترهای شبه بی دررو
در این دستگاه ها میزان داد و ستد انرژی بین ماده جاذب و پوشش آن بسیار ناچیز است و همین هدر رفت ناچیز را می توانیم از طریق منحنی درجه حرارت – دما محاسبه کنیم. ماده جاذب یا همان عنصر حرارتی در کالریمتر با پوششی احاطه شده است که این پوشش حفاظی در اطرافش دارد که به کمک همان حفاظ و سیستم کنترل بیرونی درجه حرارت پوشش قابل تغییر خواهد بود، به این صورت که در ابتلا درجه حرارت حفاظ را ثابت نگه می داریم تا پوشش و عنصر حرارتی با آن هم دما شوند، در صورتی که زمان لازم برای انجام این فرایند سپری شود، مقدار مبادله انرژی با پوشش به مقدار قابل توجهی کاهش خواهد یافت در نتیجه میزان تغییرات درجه حرارت هم کاهش می یابد.
موارد استفاده و کاربرد دستگاه کالریمتر
وقتی دو مایع A و B برای واکنش با یکدیگر داخل کالریمتر ریخته می شوند، با هم واکنش می دهند، بدین ترتیب دمای اولیه و پایانی واکنش را گوشه ای یادداشت می کنیم. اگر واکنش انجام شده گرماده باشد، می توانیم از طریق ضرب تغییرات دما با ظرفیت گرمایی ویژه و جرم مایع مقدار انرژی که طی واکنش آزاد شده است را نیز محاسبه کنیم. با داشتن این اطلاعات، تغییرات انرژی را تقسیم بر تعداد مول های شرکت کننده در واکنش، می کنیم تا آنتالپی را به دست بیاوریم. مقداری از گرمای مبادله شده نیز توسط محفظه از بین می رود یا از ظرفیت گرمایی ترمومتر و محفظه آن چشم پوشی می شود، همچنین گرمای منتقل شده بین جسم و کالریمتر یا بین جسم و مایع، همان گرمای داده شده از فلز است.
محاسبه کالری برای هر ماده ای ارزش زیادی، به ویژه ارزش اقتصادی دارد. از جمله مهم ترین کاربرد های اقتصادی آن در فروش زغال سنگ است، کاربرد ها و استفاده های دیگر این دستگاه شامل موارد زیر می باشد.
- نیروگاه ها
- معادن از جمله معدن فلزات
- صنایع شیمیایی
- متالورژی
- آزمون های سنجش کیفیت و استاندارد
- آزمایشگاه های تولیدی و تحقیقاتی و تحقیقات
دستگاه های کالریمتر تولید شده در کمپانی Ckik بسیار متنوع است.
از جمله معایب استفاده از دستگاه کالریمتر
- غیر حساس می باشد.
- به وسایل پیچیده ای نیاز دارد.
- قابل حمل نیست.
- به صورت تجاری غیر قابل دسترس است.
- عملکرد کندی داشته و مدت زمان زیادی لازم است تا از زمانی که برای اندازه گیری تنظیم می شود به پایان حرارتی برسد.
به همین دلایل است که استفاده از این دستگاه معمولا محدود به کارهای تحقیقاتی و کارهای استاندارد است.
گرماسنج چیست فیزیک دهم
گرماسنج وسیله ای است که از آن برای اندازه گیری گرمای هرنوع واکنشی استفاده می شود. این وسیله میزان گرمای جذب یا دفع شده توسط واکنش را اندازه گیری می کند. این وسیله معمولا از یک ظرف واکنش که درون یک مخزن عایق و مقدار معینی آب قرار گرفته است، تشکیل شده است.
یک گرماسنج خوب باید جدار خارجی آینه مانندی داشته باشد که از هدر رفتن تشعشع جلوگیری کند. این دستگاه از قطعاتی از جمله یک دماسنج، هم زن، در پوش عایق و در بعضی گونه ها مجهز به یک هیتر الکتریکی جهت گرم کردن محتویات درون آن، تشکیل شده است.
کالریمتر چیست
کالریمتر یا گرماسنج دستگاه مورد استفاده در آزمایشگاه های مختلف است که برای اندازه گیری کالری یا گرمای یک واکنش استفاده می شود. با استفاده از این دستگاه مقدار گرمای انتقال یافته از واکنش به محیط یا برعکس اندازه گیری می شود. این دستگاه انواع مختلفی دارد. قدیمی ترین آن از یک لیوان که درون یک محفظه قرار گرفته است، تشکیل شده است. جدیدترین نوع کالریمتر، کالریمتر دیجیتال است.
آزمایش کالریمتری
انجام آزمایش کالریمتری بسیار ساده است. ممکن است براساس نوع کالریمتر موجود در آزمایشگاه کمی روش انجام این آزمایش تغییر کند. اما اصول اولیه انجام آن یکسان است. برای انجام آزمایش کالیمتری، مایع مورد نظر را درون کالریمتر ریخته و میزان دمای اولیه و دمای پایانی واکنش را یادداشت می کنیم.
با انجام محاسبات ریاضی مانند ضرب تغییرات دما با ظریف گرمایی ویژه مایع و جرم، میزان کالری یا انرژی خارج شده یا جذب شده اندازه گیری می شود. از آزمایش کالریمتری می توان برای اندازه گیری تغییرات آنتالپی نیز استفاده کرد. برخی از کالریمترهای دیجیتال به صورت اتوماتیک محاسبات مورد نیاز را انجام می دهند.
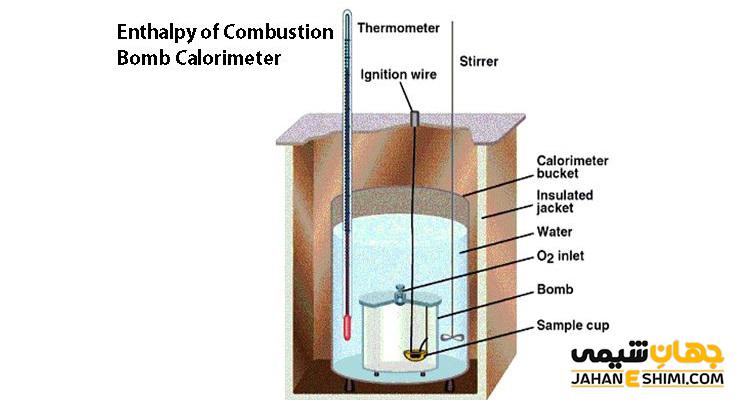
بمب کالریمتر چیست؟
بمب کالریمتر یک روش آزمایشگاهی، برای اندازه گیری و ارزیابی مواد قابل اشتعال است. با استفاده از این آزمایش می توان گرمای احتراق را اندازه گیری کرد. در این روش نمونه ماده درون دستگاه بمب کالریمتر قرار می گیرد و سپس سوزانده می شود و گرمای حاصله را به جرم معینی از آب منتقل می کنند. با توجه به وزن نمونه و افزایش دمای آب، میزان کالری جذب یا دفع شده در آزمایش اندازه گیری می شود.
بمب کالریمتر از اجزا مختلفی تشکیل شده است. جنس محفظه دستگاه بمب کالریمتر و دیواره های بیرونی این دستگاه باید از استیل ضد زنگ ساخته شده است. زیرا این دستگاه باید بتواند فشارهای بسیار بالای را به خوبی تحمل کند. اجزا این دستگاه شامل مخزن، محفظه سوخت، مخزن دو جداره حاوی آب، دماسنج، واحد کنترل جرقه زن و واحد کنترل میزان اکسیژن است.
تبادل انرژی گرمایی در کالریمتر
در آزمایش کالریمتری گرمای ایجاد شده از واکنش با مقدار معینی از آب که درون دستگاه قرار گرفته است، تبادل انرژی گرمایی دارد. این تبادل انرژی گرمای است که ما را قادر می سازد بتوانیم میزان انرژی ساطع شده یا جذب شده را اندازه گیری کنیم.
هدف از انجام آزمایش کالریمتری
هدف از انجام آزمایش کالریمتری تعیین میزان انرژی تولید شده یا ساطع شده از یک واکنش شیمیایی است. این آزمایش اطلاعات دقیقی در مورد چگونگی آزمایش، گرماگیر یا گرمازا بودن واکنش و آنتالپی واکنش به ما ارائه می دهد.
گزارش کار کالریمتری یا گرماسنجی
برای این آزمایش ابتدا مقداری آب مقطر را با استفاده از استوانه مدرج جدا کرده و داخل کالریمتر می ریزیم. دماسنج را داخل دستگاه قرار داده و دمای اولیه را به عنوان دمای T۱ یادداشت می کنیم. سپس ماده مورد نظر را اندازه گیری کرده و در داخل دستگاه کالریمتر می ریزیم و درب آن را سریعا می بندیم. دمای واکنش انجام شده را با استفاده از دماسنج داخل کالریمتر اندازه گیری می کنیم و به عنوان دمای T۲ آن را یادداشت می کنیم. در انتها دماهای بدست آمده را در فرمول زیر استفاده می کنیم تا دمای واکنش بدست آید.
Q= ∆T(m۱C۱ + m۲C۲ +A)
- که در آن Q گرمای تبادل شده
- ∆T اختلاف دما
- M جرم ماده، C ظرفیت گرمایی و A ظرفیت کالریمتر است.
روش کالریمتری چیست
کالریمتری یا گرماسنجی روشی است که برای اندازه گیری انرژی حرارتی مورد استفاده قرار می گیرد. دستگاه کالریمتر انواع مختلفی دارد ولی اساس کارکرد آنها بسیار شبیه بهم است. روش کالریمتری در واقع تغییر دمای رخ داده در بین واکنش های شیمیایی را اندازه گیری می کند.
کالریمتر رنگ سنج
رنگ سنج ابزاری آزمایشگاهی است که غلظت یک ماده را در یک نمونه با سایه رنگ آن تعیین می کند. اغلب آن را با استفاده از اسپکتروفتومتر اشتباه می گیرند. این دستگاه از قانون بیر-لامبرت برای تعیین کمیت غلظت املاح در محلول بر اساس اندازه گیری سایه رنگ مایع استفاده می کند. رنگ سنج وسیله ای است که برای اندازه گیری امواج نور به منظور تعیین سطح غلظت یک ماده خاص استفاده می شود. انواع رنگ سنج:
تراکم سنج رنگ: چگالی رنگ های اصلی را اندازه گیری کنید.
نورسنج های رنگی میزان انتقال و بازتاب رنگ ها را اندازه گیری می کنند.
رنگ سنج ها همچنین می توانند جمع و جور و قابل حمل برای استفاده در حین حرکت یا بزرگتر برای استفاده روی میزهای آزمایشگاهی باشند. انواع مختلف رنگ سنج ها برای نیازهای کاربردی مختلف مناسب هستند و انتخاب رنگ سنج مناسب می تواند دقت و کارایی اندازه گیری های شما را بهبود بخشد.
عملکرد رنگ سنج بر اساس قانون Beer-Ambert است که فرض می کند جذب نمونه مایع متناسب با غلظت آن است. رنگ سنج نور را به نمونه مایع می تاباند تا رنگ را مطابق با استانداردهای موجود تجزیه و تحلیل کند. یک فتوسل میزان جذب در طول موج را ارزیابی می کند و سپس دستگاه نتیجه را روی یک صفحه نمایش دیجیتال برمی گرداند. در رنگ سنج، یک پرتو نور با طول موج مشخص توسط یک سری عدسی از محلول عبور می کند که نور رنگی را به دستگاه اندازه گیری هدایت می کند. این رنگ را در مقایسه با استاندارد موجود تجزیه و تحلیل می کند. سپس ریزپردازنده میزان جذب یا درصد عبور را محاسبه می کند. اگر محلول غلیظ تر باشد، نور بیشتری جذب می شود.



















