واکنش گرماده چیست؟ – تغییرات آنتالپی و مثال هایی از آن
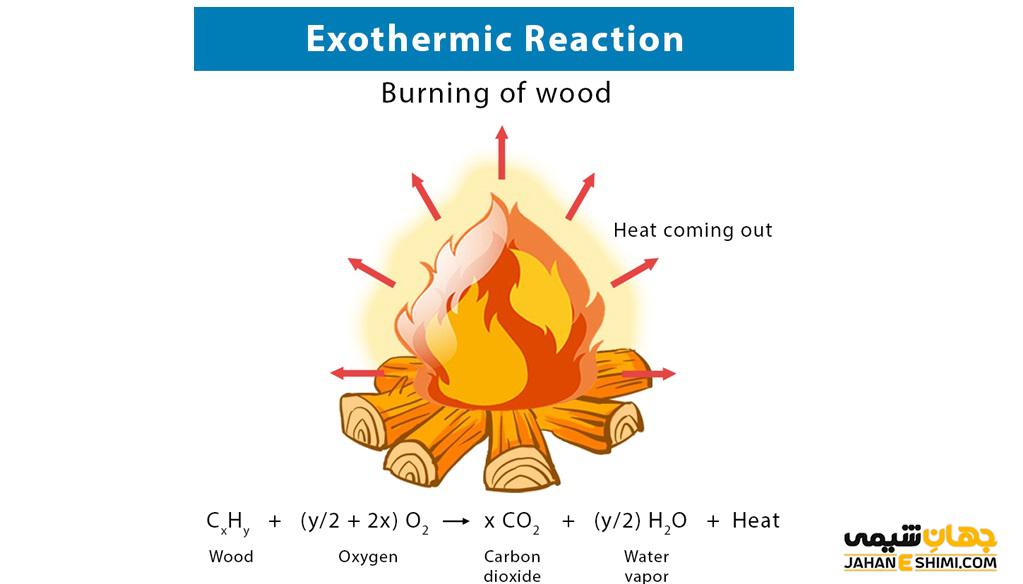
واکنش شیمیایی که در آن علاوه بر محصولات واکنش، مقداری انرژی به صورت گرما، نور و یا صدا آزاد می شود را واکنش گرماده می گویند. در این واکنش ها تغییرات آنتالپی واکنش منفی خواهد بود و سطح انرژی محصولات کمتر از سطح انرژی مواد واکنش دهنده می باشد. معرفی واکنش های گرماده و گرماگیر در کتاب علوم پایه هشتم بیان شده است. برای این که از انواع واکنش های گرماده و چگونگی تغییرات آنتالپی در آن بیشتر اطلاعات کسب کنید، این مقاله نشریه جهان شیمی فیزیک را مطالعه بفرمایید.
واکنش های گرماده و گرماگیر چیست؟
واکنش هایی که با تغییرات دما همراه هستند به نام واکنش های گرماده (اگزوترمیک) یا گرماگیر (اندوترمیک) هستند. آن دسته از واکنش هایی که به طور خود به خودی انجام شده و احتیاج به ورود انرژی برای پیشرفت واکنش ندارند به واکنش های گرماده معروف اند. در این واکنش ها تغییرات آنتالپی واکنش منفی می باشد. در این واکنش ها انرژی به صورت گرما، صدا و یا نور منتشر می شود و تغییرات آنتروپی این نوع از واکنش ها مثبت بوده و با افزایش بی نظمی همراه هستند. دمای محیط با تولید گرما در این قسم واکنش ها بالا می رود. در زندگی روزانه از واکنش های گرماده استفاده زیادی می شود. یکی از ساده ترین آن ها سوختن ماده آتشگیر کبریت با اکسیژن هوا و تولید گرما و نور می باشد.

اما در واکنش های گرماگیر دمای محیط کاهش می یابد چون واکنش به طور خود به خودی انجام نمی شود و احتیاج به ورود انرژی دارد. در این واکنش ها باید کار روی سیستم انجام شود و تغییرات آنتالپی در آن ها مثبت می باشد.
سطح انرژی مواد در واکنش گرماده و تئوری آن
طبق اصل قانون بقای انرژی، هیچ انرژی در دنیا از بین نمی رود و مقدار ثابتی دارد. فقط صورت های مختلف انرژی به هم تبدیل می شوند. وقتی یک واکنش شیمیایی انجام می شود، پیوند های مواد اولیه گسسته و پیوندهای جدیدی تشکیل می شود. شکستن پیوندها با مصرف انرژی و تشکیل پیوندهای جدید با آزاد شدن انرژی همراه است. در واکنش های اگزوترمیک مقدار انرژی آزاد شده بیشتر از مقدار انرژی مصرف شده است. در نمودار تغییرات انرژی، سطح مواد واکنش دهنده بالاتر از سطح انرژی محصولات می باشد.

تأثیر تغییرات دما به یک واکنش گرمازا
در یک واکنش گرمازا وقتی تعادل شیمیایی برقرار می شود، می توان ثابت تعادل را از تقسیم حاصل ضرب غلظت محصولات به مواد اولیه به توان ضریب استوکیومتری آن ها به دست آورد. اگر در شرایط واکنش تغییر ایجاد شود، طبق اصل لوشاتلیه تعادل جابه جا می شود. واکنش گرمازا به شکل زیر است :
گرما (انرژی) + محصولات → مواد واکنش دهنده
طبق اصل لوشاتلیه افزایش دما باعث جابه جایی واکنش به سمت چپ می شود و کاهش دما واکنش را به سمت راست پیش می برد.
بررسی ترمودینامیکی واکنش های گرماده
واکنش های گرمازا به طور خود به خودی انجام می شوند و G∆ (انرژی آزاد گیبس) کمیتی از محتوای آنتالپی و تغییرات آنتروپی است، که میزان خود به خودی بودن یک واکنش را تعیین می کند. به دلیل این که سرعت در ترمودینامیک تعریف نمی شود، یک واکنش خود به خودی را نمی توان گفت حتما انجام می شود. حتما باید یک نیروی خارجی برای انجام واکنش وجود داشته باشد. مثلا اگر عامل محرکی برای واکنش اکسیژن با کربن نباشد، هیچ بر همکنشی نخواهند داشت. انرژی آزاد گیبس با فرمول زیر تعریف می شود.
∆ G = ∆ H _ T ∆ S

در یک واکنش گرمازا چون واکنش خود به خودی است، میزان بی نظمی و تغییرات آنتروپی (S∆) آن مثبت است. در نتیجه حاصل ضرب دما (T) در تغییرات آنتروپی مثبت می شود. تغییرات آنتالپی که منفی می باشد، پس با جاگذاری در معادله بالا مقدار انرژی آزاد گیبس منفی بوده و واکنش خود به خودی می شود.
نکته :
از روش کالری متری سنجشی مقیاسی می توان تغییرات آنتالپی یک واکنش استفاده می شود.
کالری متر
کالری متر دستگاهی است که برای تعیین ظرفیت گرمایی ویژه، تغییرات فیزیکی و دمای واکنش استفاده می شود. یک کالری متر ساده آزمایشگاهی را می توان از دو بشر ساده در سایزهای مختلف که داخل هم قرار گرفتند ساخت. بین آن ها را از مواد عایقی پر می کنند تا تبادل گرمایی با محیط بیرون نداشته باشند. یک دماسنج را از سوراخی که قسمت وسط درب این مجموعه قرار دارد، عبور می دهند. با ریختن مواد واکنش دهنده داخل کالری متر و یادداشت کردن دمای اولیه و دمای پایانی آن واکنش می توان، گرمای واکنش را به دست آورد. گرمای واکنش که از حاصل ضرب جرم مواد واکنش دهنده در ظرفیت گرمایی ویژه آن ها و در تغییرات دما به دست می آید، گرماده یا گرماگیر بودن واکنش را تعیین می کند.
تفاوت بین واکنش های گرماده و گرماگیر
در واکنش های گرمازا محتوای گرمایی محصولات کمتر از مواد واکنش دهنده بوده و تغییرات آنتالپی واکنش، منفی می باشد. اما در واکنش های گرماگیر محتوای انرژی محصولات بیشتر از مواد واکنش دهنده و تغییرات آنتالپی، مثبت است. تغییرات آنتروپی و بی نظمی در واکنش های گرمازا مثبت و مقدار آن افزایش می یابد، اما در واکنش های گرماگیر منفی می باشد. وقتی یک واکنش اگزوترمیک انجام می شود، با تولید گرما محیط واکنش گرم می شود ولی در واکنش اندوترمیک دمای محیط واکنش کاهش می یابد. انرژی آزاد گیبس در یک واکنش اگزوترمیک منفی و واکنش خود به خودی، ولی در واکنش اندوترمیک، مثبت و غیر خود به خودی است.
مثال هایی از واکنش گرماده
در یک واکنش شیمیایی گرمازا همان طور که گفتیم انرژی به صورت گرما آزاد می شود. پس در هر واکنشی محصولات همراه با گرمای آزاد شده مشاهده شد، باید گفت واکنش گرمازا و اگزوترمیک است. از مهمترین واکنش های گرمازا، سوختن ماده سوختنی با اکسیژن و تولید مقدار زیادی انرژی به صورت گرما است. از واکنش های سوختن می توان به ترکیب هیدروژن با اکسیژن اشاره کرد که محصول آن آب می باشد. در این واکنش مقدار زیادی گرما تولید می شود.
۴H۲ + O۲ → ۲H۲O + Q

Q همان گرمای آزاد شده از واکنش می باشد. همچنین هیدروکربن ها با واکنش با اکسیژن، تولید آب، دی اکسید کربن و گرما می کنند. از حیاتی ترین واکنش های گرمازا تنفس است که در آن اکسیژن با گلوکز خون واکنش داده و طبق واکنش زیر آب، دی اکسید کربن و گرما تولید می کند.
C۶H۱۲O۶ + ۶ O۲ → ۶ CO۲ + ۶ H۲O + Q
از واکنش های گرمازای دیگر می توان به تبلور نمک های مایع، واکنش خنثی سازی، واکنش پلیمریزاسیون، مخلوط آب با کلسیم کلرید، ادغام هسته ای، تشکیل برف، انحلال اسیدها و بازها در آب، انحلال اکسیدهای فلزی در آب، میعان (تبدیل گاز به مایع)، انجماد (تبدیل مایع به جامد)، چگالش (تبدیل گاز به جامد)، انحلال گازها در آب، اکسیداسیون فلزات و… را نام برد.
انفجار یکی از واکنش های گرمازاست به عنوان مثال دینامیت ها و TNT می توانند انرژی بسیار زیادی را تولید کنند.
واکنش های گرمازا در صنعت
دمای بسیار بالایی که برای گداختن و تصفیه آهن در کوره ها لازم است از واکنش سوختن کک با اکسیژن حاصل می شود. ابتدا در این کوره ها جریانی از هوای داغ عبور داده می شود، واکنش اکسیژن با کک مقدار بسیار زیادی گرما تولید می کند که ذوب سنگ آهن با این گرما انجام می شود.
گرماگیر و گرماده چیست علوم هشتم
واکنش های گرمازا و گرمازا به جذب یا انتشار گرما اشاره دارد. انواع دیگر انرژی ممکن است توسط یک واکنش شیمیایی تولید یا جذب شوند (مثلاً نور و صدا). به طور کلی، واکنش های شامل انرژی را می توان به عنوان اگزرگونیک یا اگزرگونیک طبقه بندی کرد، واکنش گرماگیر نمونه ای از واکنش های اندرگونیک است. واکنش گرمازا نمونه ای از واکنش اگزرگونیک است.
واکنش های گرماگیر و گرمازا، واکنش های شیمیایی هستند که به ترتیب گرما را جذب و آزاد می کنند. فتوسنتز نمونه خوبی از یک واکنش گرماگیر است. احتراق نمونه ای از واکنش گرمازا است. طبقه بندی یک واکنش به عنوان گرماگیر یا گرمازا بستگی به انتقال حرارت خالص دارد. در هر واکنش معین، گرما هم جذب و هم آزاد می شود. برای مثال، برای شروع یک واکنش احتراق باید انرژی وارد شود (روشن کردن آتش با کبریت)، اما پس از آن گرمای بیشتری از آنچه لازم است آزاد می شود.
در واکنش های گرمازا:
- انرژی به محیط اطراف داده می شود
- بنابراین انرژی محصولات کمتر از انرژی واکنش دهنده ها خواهد بود
- تغییر کلی انرژی منفی است
در واکنش های گرماگیر:
انرژی از محیط اطراف گرفته می شود
انرژی محصولات بیشتر از انرژی واکنش دهنده ها خواهد بود
تغییر انرژی کلی مثبت است