
خارج قسمت واکنش (Reaction Quotient) یا بهره واکنش در شیمی، معیاری جهت پیش بینی پیشرفت یک واکنش شیمیایی و همچنین جهت آن واکنش در مسیر رفت یا برگشت است. این کمیت با نماد Q و یا Qr نمایش داده می شود. بهره واکنش در حقیقت تابعی از غلظت و یا فعالیت گونه های شیمیایی درگیر در یک واکنش شیمیایی است. به کمک بهره واکنش می توان مقادیر نسبی محصولات و واکنشگر های یک واکنش شیمیایی را در زمانی مشخص، سنجید. در نهایت با استفاده از مقایسه میان ثابت تعادل واکنش (Equilibrium Constant) و خارج قسمت آن واکنش، می توان جهت و مسیر واکنش شیمیایی در حال انجام را تعیین کرد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی خارج قسمت واکنش پرداخته می شود. لطفا با ما همراه باشید.
خارج قسمت واکنش
زمانیکه واکنش دهنده ها در ظرف واکنش ریخته شوند، شروع به واکنش با یکدیگر نموده و محصولات واکنش، تولید می شوند. در این حالت و قبل از ایجاد تعادل شیمیایی (Chemical equilibrium)، اگر واکنشگر ها و فرآورده ها در ظرف واکنش وجود داشته باشند، واکنش رفت و واکنش برگشت از همان ابتدا انجام می شوند. به منظور تشخیص اینکه واکنش مورد نظر در جهت رفت پیش می رود یا در جهت برگشت، باید خارج قسمت واکنش محاسبه شود. تفاوت اصلی میان خارج قسمت واکنش و ثابت تعادل آن واکنش در اینست که ثابت تعادل، در حقیقت یک واکنش را در حالت تعادل توصیف می کند. در حالیکه، خارج قسمت واکنش جهت توصیف یک واکنش شیمیایی در حالت غیر تعادلی مورد استفاده قرار می گیرد. بنابراین در ادامه، ابتدا تعادل شیمیایی و ثابت تعادل به اختصار شرح داده می شوند.

تعادل شیمیایی واکنش
تعادل شیمیایی به حالتی گفته می شود که در طی آن، فعالیت شیمیایی و یا غلظت گونه های شیمیایی درگیر در واکنش، با گذشت زمان در واکنش شیمیایی تغییر نکنند. این تعادل به طور معمول در شرایطی بوجود می آید که سرعت واکنش رفت با سرعت واکنش برگشت برابر باشد. از این جهت از نماد فلش دو طرفه (⇌) بهره می برند. فلش دو طرفه به خوبی بیان می کند که واکنش مورد نظر می تواند در جهت تولید واکنش دهنده ها یا در جهت تولید فرآورده ها، انجام شود.
لازم به ذکر است که يك سیستم در صورتی در حال تعادل قرار می گیرد که كاملا بسته و ايزوله باشد. یعنی میان سیستم و محيط اطرافش هیج گونه تبادل انرژی و یا جرم انجام نگیرد. همچنین، خواص ماكروسكوپی آن سیستم (مانند جرم، حجم، رنگ، جرم حجمي و غیره) ثابت و بدون تغییر باقی بماند. واکنش بین واکنش دهنده ها و فرآورده ها در یک سیستم در حال تعادل، در سطح ميكروسكوپی ادامه داشته باشد. در نهایت، سرعت واکنش رفت با سرعت واکنش برگشت، برابر و مساوی باشد.
ثابت تعادل واکنش
از تقسیم ثابت سرعت واکنش رفت (kf) بر ثابت سرعت واکنش برگشت (kr)، ثابت تعادل (K) واکنش بدست می آید. به عبارت دیگر، ثابت تعادل به معادله ای که در یک حالت تعادل شیمیایی، بین غلظت مواد اولیه و محصولات برقرار است، گفته می شود. به عنوان مثال، واکنش تعادلی زیر را در نظر بگیرید:
aA + bB ⇌ cC + dD
در این معادله، حروف بزرگ نشان دهنده مواد اولیه و محصولات و حروف کوچک نیز نشان دهنده ضرایب استوکیومتری آنها می باشند. معادله ثابت تعادل در حالت کلی به صورت زیر خواهد بود.

در معادله بالا، [A] و [B] غلظت های تعادلی واکنشگر ها بر حسب مولاریته (مول بر لیتر)، [C] و [D] غلظت های تعادلی محصولات بر حسب مولاریته هستند. ضرایب c ،b ،a و d نیز ضرایب استوکیومتری معادله موازنه شده می باشند.
محاسبه خارج قسمت واکنش
زمانیکه غلظت مواد اولیه و محصولات در رابطه ثابت تعادل صدق کنند، یعنی با جایگذاری غلظت آنها در معادله فوق، عدد ثابت تعادل بدست آید، غلظت های مورد نظر غلظت های تعادلی خواهند بود. در حالیکه، اگر غلظت های مورد نظر در رابطه ثابت تعادل صدق نکنند، در نتیجه واکنش مورد بررسی به تعادل شیمیایی نرسیده است. بدین شکل، واکنش در حالت تعادل قرار ندارد. در چنین وضعیتی، اگر غلظت واكنش دهنده ها و فرآورده ها را در رابطه ثابت تعادل قرار دهند، عدد بدست آمده را خارج قسمت می نامند. دقت داشته باشید که جهت تعیین خارج قسمت واکنش، باید غلظت مواد اولیه و فرآورده ها مشخص باشد. معادله خارج قسمت واکنش به صورت زیر است:
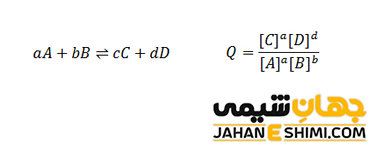
به بیان ساده تر، بهره واکنش برابر با حاصل ضرب غلظت فرآورده ها به توان ضرایبشان تقسیم بر حاصل ضرب غلظت واکنشگر ها به توان ضرایبشان است. رابطه بهره واکنش در حقیقت همان رابطه ثابت تعادل برای واکنش مورد نظر است. با این تفاوت که در رابطه بهره واکنش، غلظت های غیر تعادلی را می توان جایگذاری کرد. لازم به ذکر است که مقدار Q می تواند صفر تا بی نهایت (۰ ≤ Q ≤ بینهایت) نیز باشد. در حالیکه، این حالت برای K صدق نمی کند. زیرا ثابت تعادل مربوط به حالت تعادل شیمیایی است و همانطور که می دانید، در حالت تعادل، غلظت هیچیک از گونه های درگیر در واکنش صفر نیست.
مقایسه خارج قسمت واکنش با ثابت تعادل
همانطور که بیان شد، با جایگزینی غلظت های موجود در رابطه خارج قسمت واکنش، می توان مقدار Q را تعیین کرد. سپس مقدار Q با مقدار K مقایسه می شود. با مقایسه مقادیر بدست آمده از رابطه خارج قسمت واکنش و ثابت تعادل آن واکنش، می توان مسیر و جهت پیشرفت واکنش مورد نظر را برای رسیدن به حالت تعادل مشخص نمود. در صورت وجود تفاوت میان مقادیر Q و K، واکنش شیمیایی مورد نظر در جهتی انجام یا جابجا می گردد که مقدار Q به مقدار K برسد. در این حالت تعادل شیمیایی برقرار می شود. بدین شکل، سه حالت مختلف پیش می آید که عبارتند از :
Q = K. در این حالت، سیستم در حال تعادل می باشد. بنابراین مقدار واکنشگر ها و محصولات، بدون تغییر باقی می مانند.
Q < K. در این حالت، غلظت واکنشگر ها بیشتر از غلظت فرآورده ها می باشد. بنابراین، غلظت واکنش دهنده ها که در مخرج رابطه Q قرار دارند، باید کاهش یابد. همچنین غلظت فرآورده ها نیز که در صورت رابطه Q قرار دارند، باید افزایش یابد. بدین شکل، مقدار Q زیاد شده و به مقدار K خواهد رسید. بنابراین واکنش به سمت فرآورده ها حرکت کرده و تا رسیدن به تعادل ادامه پیدا می کند.
Q > K. در این حالت، غلظت محصولات بیشتر از غلظت مواد اولیه می باشد. بنابراین، غلظت واکنشگر ها که در مخرج رابطه Q قرار دارند، باید افزایش پیدا کند. همچنین غلظت محصولات نیز که در صورت رابطه Q قرار دارند، باید کاهش یابند. در اینصورت، مقدار Q کم شده و به مقدار K خواهد رسید. بنابراین واکنش به سمت چپ (مواد اولیه) حرکت کرده و تا رسیدن به تعادل ادامه پیدا می کند.

محاسبه خارج قسمت واکنش با استفاده از فعالیت
لازم به ذکر است که در محاسبات خارج قسمت واکنش، به جای استفاده از غلظت مولی مواد، از فعالیت شیمیایی (Activity) یا اکتیویته آنها استفاده می کنند. توجه داشته باشید که فعالیت شیمیایی با غلظت و یا فشار جزئی متفاوت است. به علاوه، فعالیت واحد ندارد، پس مقدار Q اغلب بدون واحد بیان می شود. زیرا در واقع، فعالیت از تقسیم کردن غلظت یا فشار واقعی یک ماده بر غلظت یا فشار همان ماده در حالت استاندارد بدست آمده است. جالب است بدانید که برای یک مایع یا جامد خالص، مقدار اکتیویته برابر با یک می باشد. بنابراین، از رابطه Q حذف می شوند.



















