قانون پایستگی جرم به زبان ساده چیست ؟
یکی از بنیادی ترین قوانین شیمی و فیزیک قانون پایستگی جرم است. طبق این قانون در یک سیستم بسته (سیستمی که هیچ ماده و انرژی نه به آن وارد شود ونه از آن خارج شود) وقتی واکنشی انجام می شود

جرم و تعداد همه عناصر واکنش دهنده ثابت و بدون تغییر می ماند. در حل حاضر این قانون با قانون پایستگی انرژی ترکیب شده و قانون پایستگی جرم و انرژی نام گذاری شده است. اولین کسی که این قانون را با انجام آزمایش های مختلف و بررسی جرم آن ها در انجام واکنش با استفاده از وزن کردن آن ها توضیح داد آنتوان لاوازیه بود. این کار این دانشمند بزرگ تحولی بسیار عظیم در علم شیمی به وجود آورد که امروزه در شیمی و مکانیک کاربرد زیادی دارد. این مقاله نشریه جهان شیمی فیزیک به بیان توضیحاتی درباره این قانون بزرگ می پردازد.
قانون و اصل لاوازیه
اصل قانون پایستگی جرم قبل از لاوازیه توسط دانشمند روسی به نام میخاییل لومونسف بیان شد. در سال ۱۷۸۲ لاوازیه این قانون مهم را بیان کرد: «چون در هر واکنشی کمیت مواد ثابت است با توزین واکنش دهنده ها و محصولات می توان گفت که در حین انجام واکنش هیچ ماده ای نه به وجود می آید و نه از بین می رود فقط از صورتی به صورت دیگر تبدیل می شود.» وقتی واکنشی انجام می شود و ماده ای به ماده دیگر تبدیل می شود جرم واکنش دهنده ها با جرم فراورده ها برابر است.
به بیانی دیگر :
وزن کلی ماده تغییر نمی کند و فقط ماده از صورتی به صورت دیگر تبدیل می شود. فعل و انفعالات شیمیایی در یک واکنش هیچ ماده ای را ازبین نمی برد و یا چیزی به آن اضافه نمی کند. لاوازیه برای رسیدن به این اصل در ظرفی عایق (بسته) جرم همه مواد را قبل و بعد از انجام واکنش به طور دقیق با ترازو وزن کرد و به برابری آن ها رسید.
این اصل به نام قانون پایستگی جرم بیان شد که در کتاب های علوم پایه هفتم، هشتم، نهم و شیمی دهم آورده شده است.

توجه :
علت اینکه اصل بقای جرم چندین هزار سال از نظرها دور مانده بود تاثیر نیروی شناوری بود که جو زمین روی وزن گازها داشت. به عنوان مثال در سوختن چوب وزن خاکستر تولید شده خیلی کمتر از چوب سوخته است. طبق تئوری فلوژیستن (جرم در هنگام سوختن تولید می شود یا از بین می رود)، باید گفته می شد جرم چوب از بین رفته است. اما وقتی در قرن هفدهم این واکنش در یک فضای ایزوله (سیستم بسته) که از هوا تخلیه شده بود انجام شد مشخص شد که باقیمانده چوب به گاز تبدیل شده است. همین جا نظریه فلوژیستن رد شد. این کشف به قدری مهم است که علم شیمی را دو هزار سال نسبت به قبلش در طی ۲۰۰ سال بعدش پیشرفت داد.
درک قانون پایستگی جرم در واکنش های شیمیایی
قانون پایستگی به عنوان ثابت بودن یک کمیت فیزیکی در یک سیستم در هنگام تحولات آن سیستم تعریف می شود. قانون پایستگی جرم نمونه ای از این قانون است که جرم مواد در آن در حین واکنش های شیمیایی و فیزیکی ثابت می ماند. به عنوان مثال وقتی ۲۰ گرم یخ ذوب می شود به ۲۰ گرم آب تبدیل می شود. همچنین ۲۰ گرم آب بخار شود ۲۰ گرم بخار آب حاصل می شود. اگر ۱۰ کیلوگرم چوب بسوزد ۱۰ کیلوگرم خاکستر، دوده و گرد و غبار تولید می کند نه بیشتر و نه کمتر.
در نتیجه :
هیچ ماده ای در واکنش از بین نمی رود و یا هیچ ماده ای به واکنش اضافه نمی شود فقط یا به حالتی دیگر تبدیل می شود ( فرایند فیزیکی) یا به ماده ای دیگر بدل می شود (واکنش شیمیایی).
مثال کاربردی قانون پایستگی جرم در واکنش شیمیایی
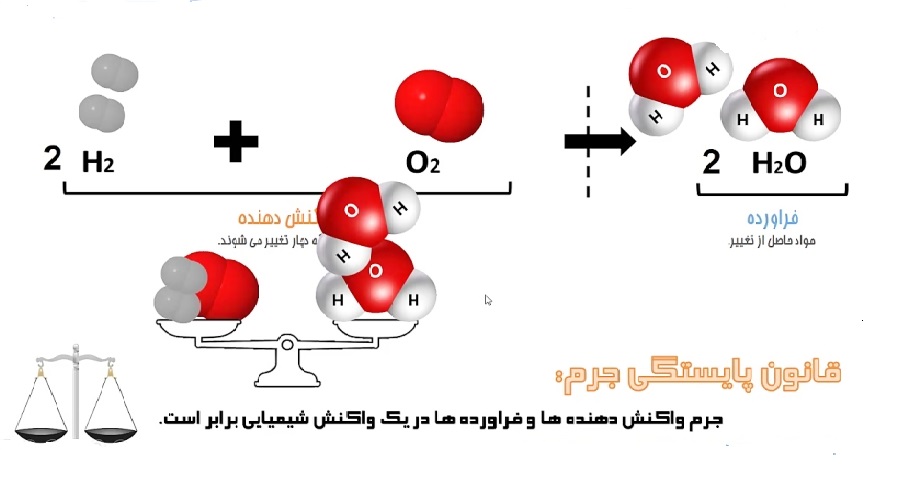
در واکنش تولید آب در سیستم بسته (هیچ تبادل گرما و انرژی با محیط ندارد) اگر ۴ گرم هیدروژن با ۳۲ گرم اکسیژن ترکیب شود ۳۶ گرم آب (مجموع جرم های اکسیژن و هیدروژن) تولید می کند.
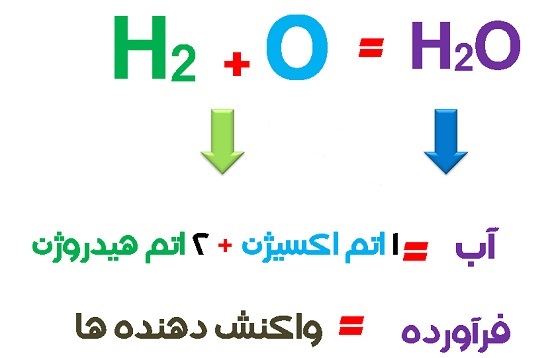
۲H۲ + O۲ → ۲H۲O
جرم واکنش دهنده ها = جرم فرآورده ها
موازنه بودن واکنش های شیمیایی
هر واکنش شیمیایی با یک معادله شیمیایی بیان می شود. معادله تشکیل آبی که در بالا بیان شد این موضوع را بیان می کند. در معادله تشکیل آب دو مولکول هیدروژن با یک مولکول اکسیژن ترکیب شده و دو مولکول آب می دهد. وقتی صحبت از قانون پایستگی جرم می شود باید واکنش موازنه شده باشد یعنی تعداد هر یک از اتم های تشکیل دهنده واکنش دهنده ها و فرآورده ها در دو طرف واکنش باید برابر باشند. در استوکیومتری واکنش ضرایبی که پشت مولکول ها در معادله واکنش قرار می گیرند برای برابر کردن تعداد اتم ها در دو سمت واکنش است که معادله را موازنه می کند. در قانون بقای جرم در معادله موازنه شده وقتی تعداد اتم ها در دوسمت یکی باشد، جرم آن ها نیزدر دو طرف واکنش برابر خواهد بود.
قانون پایستگی جرم در فیزیک مدرن
وقتی نظریه نسبیت در فیزیک بیان شد قانون پایستگی جرم با این نظریه توسط آینشتاین در سال ۱۹۰۵ مورد بررسی قرار گرفت. معادله ای که او برای برقراری ارتباط بین ماده و انرژی بیان کرد از نظریه تبدیل انرژی داخلی سیستم به جرم سیستم و تبدیل جرم به تابش الکترومغناطیسی برخوردار بود. نظر پلانک تا آن زمان این بود که مقدار تغییر در جرم با تبادل انرژی خیلی کوچک است که با وسایل قابل دسترس در آن زمان نمی توانست اندازه گیری شود. اما آینشتاین معتقد بود که انرژی تولید شده در مقایسه با جرم سیستم تولید کننده آن به قدری است که با خارج شدن از سیستم اندازه گیری تغییرات جرم آن را امکان پذیر می کند. بعدها تست شد که این نظریه آینشتاین دال بر کم شدن جرم در صورت کم شدن انرژی درست است.
قانون پایستگی جرم و انرژی
در سال های بعد با بیان نظریه نسبیت قانون پایستگی جرم را انیشتین به قانون پایستگی جرم و انرژی اصلاح کرد. طبق این قانون مقدار انرژی نیز در واکنش ها ثابت است. انرژی می تواند از صورتی به صورت دیگر تبدیل شود اما از بین نمی رود. بیان کلی این قانون این است در کل واکنش ماده و انرژی به یکدیگر تبدیل می شوند اما مقدار آن ها ثابت مانده و در دنیا و جهان هستی مقدار ماده و انرژی تغییری نمی کند.
قانون پایستگی جرم علوم نهم
قانون بقای جرم بیان می کند که جرم در یک واکنش شیمیایی نه ایجاد می شود و نه از بین می رود. این بدان معناست که در یک سیستم بسته، جرم عناصر درگیر در ابتدا در یک واکنش شیمیایی برابر با جرم محصول حاصل از واکنش است. از این رو، برای هر نوع واکنش شیمیایی، جرم کل واکنش دهنده ها و محصولات درگیر حفظ می شود. این مفهوم بقای جرم نه تنها در شیمی بلکه در زمینه های دیگری مانند مکانیک، دینامیک و غیره به طور گسترده مورد استفاده قرار می گیرد.
به همین ترتیب، طبق قانون بقای انرژی، انرژی ایجاد یا از بین نمی رود. سیستمی که از محیط اطراف خود جدا است، سیستمی است که با آن تعامل ندارد. در نتیجه، مهم نیست که چه تغییرات یا واکنش های شیمیایی در آن سیستم جدا شده رخ می دهد، جرم ثابت می ماند. حتی اگر حالت نهایی ممکن است با حالت اولیه متفاوت باشد، جرم کمتر یا بیشتر از قبل از تغییر یا واکنش وجود نخواهد داشت.
درک این موضوع که مواد در واقع در نتیجه یک واکنش ناپدید نمی شوند، علیرغم آنچه ممکن است به نظر برسد، بلکه به ماده دیگری با جرم مساوی تبدیل می شوند. به عنوان مثال، هنگامی که یک وسیله نقلیه اسباب بازی از سطح شیبدار پایین می رود و با دیوار برخورد می کند، انرژی جنبشی به انرژی پتانسیل تبدیل می شود.
هنگامی که ماده دچار تغییر شیمیایی می شود، قانون بقای جرم صادق است. این را می توان با کمک مثال زیر فهمید. یک مول سدیم هیدروکسید (NaOH) و یک مول اسید کلریدریک (HCl) را بردارید و اجازه دهید در یک لوله آزمایش واکنش دهند، پس از واکنش متوجه خواهید شد که یک مول کلرید سدیم (NaCl) و یک مول آب ( H2O) تشکیل می شود. که قانون بقای جرم را تعیین می کند.
توضیح کامل قانون پایستگی جرم
قانون پایستگی جرم یکی از مهمترین قوانین طبیعت است که آن طی یک واکنش شیمیایی، مقدار کل جرم مواد هیچ وقت کم یا زیاد نمی شود. به عبارت دیگر، جرم مواد قبل از واکنش برابر است با جرم مواد بعد از واکنش. این قانون نخستین بار توسط آنتوان لاوازیه کشف کرد و او با آزمایشات مختلف این قانون را اثبات کرد.
مثلا اگر مقداری آهن را در هوای بسته بسوزانیم، آهن با اکسیژن هوا ترکیب می شود و اکسید آهن تولید می شود. مجموع جرم آهن و اکسیژنی که وارد واکنش شده اند دقیقاً برابر است با جرم اکسید آهنی که تولید شده است.
این قانون برای همه واکنش های شیمیایی حتی گازها نیز صادق است. زیرا اتمها در واکنشها نابود یا ایجاد نمی شوند، بلکه فقط از هم جدا شده و دوباره به شکل جدیدی کنار هم قرار می گیرند.
قانون پایستگی جرم در زندگی روزمره مثلا در صنایع شیمیایی، آشپزی، سوختن سوختها و حتی در بدن انسان که مواد غذایی به انرژی و مواد دیگر تبدیل می شوند نیز صادق است.



















