یون هیدرونیوم چیست؟ – ساختار لوئیس و چگونگی تشکیل آن
کاتیون آبی H۳O+ که حاصل ترکیب پروتون و آب است به نام یون هیدرونیوم نامیده می شود. این یون به عنوان معیاری است که قدرت اسیدی محلول های آبی را با آن مورد ارزیابی قرار می دهند. یون هیدرونیوم همراه با یون هیدروکسید، مولکول آب را تشکیل می دهند. اتم هیدروژن با از دست دادن یک الکترون خود، این یون را تشکیل می دهد. این مقاله نشریه جهان شیمی فیزیک ما را با یون هیدرونیوم، ساختار شیمیایی و محاسبه PH به کمک غلظت آن آشنا می کند.
یون هیدرونیوم
در حالت عادی اتم هیدروژن یک پروتون و یک الکترون دارد، ولی نوترون ندارد. اما یون هیدروژن که در نتیجه ی از دست دادن یک الکترون اتم هیدروژن به دست می آید، فقط یک پروتون داشته و به نام پروتون نیز نامیده می شود. از خواص فیزیکی این یون، داشتن چگالی بالاست که باعث واکنش پذیری بالای این یون شده است. علت آزاد بودن آن در محیط آبی و توانایی جذب جفت الکترون ناپیوندی اکسیژن به صورت داتیو نیز همین است. در این شرایط، یون پروتون به صورت آبپوشیده در آمده و یون هیدرونیوم را تشکیل می دهد. در آیوپاک این یون را به نام اکسونیوم می نامند.
با این که یون هیدروژن مثبت به صورت H+ درست است ولی به قدری این یون با آب دارای واکنش پذیری بالایی است که حتما به صورت H۳O+ وجود دارد. به همین دلیل، بهتر است که این یون را به این شکل نوشته شود. وقتی یون مذکور را به صورت H+ می نویسیم، باید دقت کنیم که این یون در محلول های آبی به صورت یون هیدرونیوم است.
دو دلیل می توان برای درست بودن نوشتن این یون به صورت هیدرونیوم بیان کرد. یکی این که این شکل، نشان دهنده مولکول بوده و دیگری نشان دهنده اسید مزدوج آب است.
تشکیل هیدرونیوم
دو روش خودیونش آب و واکنش اسید و آب، برای تشکیل هیدرونیوم وجود دارد.
خود یونش آب
یکی از راه های تشکیل یون مورد بحث، ترکیب یون های هیدروکسید و H+ است که به خود یونش آب معروف است. میزان PH را می توان با استفاده از نسبت میان این دو یون به دست آورد. معادله خودیونش آب را به صورت زیر می نویسند.
H۲O(l) + H۲O(l) → OH–(aq) + H۳O+
مولکول آب از اتم اکسیژن با الکترونگاتیوی بالا و هیدروژن تشکیل شده است. آب یک مولکول قطبی است زیرا اتم اکسیژن نسبت به هیدروژن، الکترونگاتیوی بالایی دارد. در نتیجه اکسیژن بار جزئی منفی و هیدروژن بار جزئی مثبت می گیرد. بار جزئی اکسیژن در مولکول آب به جذب یون های هیدروژن منجر می شود. در نتیجه ی این پیوند، یون هیدرونیوم به وجود می آید.
یون هیدروژن فاقد الکترون بوده، در نتیجه اکسیژن مولکول آب، الکترون به هیدروژن داده و یون را تشکیل می دهد. دو الکترونی که به اتم اکسیژن تعلق دارند، در پیوند داتیو یا کووالانس کوئوردیناس با هیدروژن شرکت می کند.
مولکول آب قطبی است و دلیل آن علاوه بر بالا بودن الکترونگاتیوی اکسیژن، داشتن ساختار نامتقارن مولکول آن است. ساختار مولکولی آب به گونه ای است که گشتاور دوقطبی الکتریکی دارد که برای سنجش میزان قطبیت یک مولکول به کار می رود. این معیار با واحد کولن بر متر بیان می شود.
واکنش اسید با آب
یکی دیگر از راه های تشکیل یون هیدرونیوم، واکنش اسید با آب است. در واکنش خنثی شدن، اسیدها و بازها با هم ترکیب شده و یون های هیدروژن آزاد شده از اسیدها با مولکول های آب، تشکیل یون هیدرونیوم می دهد. از ترکیب اسید کلریدریک با هیدروکسید سدیم، H+ آزاد شده از اسید با آب ترکیب شده و هیدرونیوم تشکیل می شود.
یون هیدروژن به صورت آزاد در آب وجود ندارد
در محلول های آبی، یون هیدروژن یونی است که الکترون نداشته و فقط یک پروتون دارد. در نتیجه یونی با بار مثبت است. پروتون موجود در اتم هیدروژن، صد میلیونیوم حجم آن را تشکیل می دهد. چنین وضعیتی نشان دهنده چکالی بار الکتریکی بالای پروتون است. پس این یون قدرت بالایی در جذب اتم و یا مولکول با بار منفی دارد. همان طور که در بالا نیز گفته شد، جفت الکترون های غیرپیوندی اتم اکسیژن در مولکول آب با پروتون پیوند داتیو برقرار می کنند. در این پیوند می توان آب را به عنوان یک باز و دهنده الکترون و پروتون به عنوان یک اسید و یا پذیرنده الکترون در نظر گرفت.
یک از نکاتی که در تشکیل یون هیدرونیوم در محلول های آبی مورد توجه است، عدم اتصال پروتون به مولکول آب است. زیرا این یون با تعداد دفعات زیاد روی مولکول های مختلف در هر ثانیه جا بجا شده و یون هیدرونیوم تشکیل می دهد. علت این امر داشتن سایز و جرم و در نتیجه ی آن ها چگالی مخصوص این یون است. با این رفتار یون هیدرونیوم می توان گفت این یون در میان این مولکول ها حرکت می کند. همین حرکت باعث شده است که اسیدها و بازها (حرکت یون هیدروکسید)، رسانای خوبی باشند.
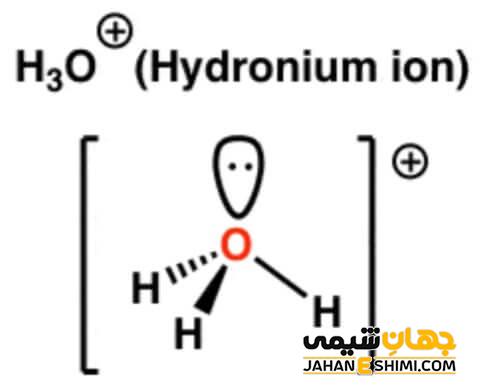
ساختار لوئیس یون هیدرونیوم
در این یون، اتم های اکسیژن و هیدروژن سه پیوند یگانه O – H را تشکیل می دهند. در ساختار لوئیس هیدرونیوم مانند بسیاری از ترکیبات دیگر، اتم های تشکیل دهنده از قاعده هشت تایی پیروی می کنند. برای رسم ساختار الکترونی این ترکیب به ترتیب زیر عمل می کنیم.
ابتدا تعداد الکترون های ظرفیت را در عناصر سازنده آن تعیین می کنیم. هیدروژن در گروه اول جدول تناوبی قرار گرفته و یک الکترون ظرفیت دارد. اکسیژن نیز در گروه ۱۶ جدول تناوبی بوده و تعداد الکترون های ظرفیت آن، ۶ است. در نتیجه با توجه به این که در این یون، ۳ اتم هیدروژن و یک اتم اکسیژن وجود دارد، تعداد ۹ الکترون ظرفیت باید باشد. ولی به دلیل این که این یون با از دست دادن یک الکترون، دارای یک بار مثبت است، تعداد الکترون های ظرفیت آن ۸ است.
سپس از حاصل جمع تعداد پیوندهای سیگما، تعداد پیوندهای پای و تعداد جفت الکترون های غیرپیوندی، تعداد جفت الکترون های پیوندی به دست می آید. به این ترتیب تعداد جفت الکترون های پیوندی در این ترکیب برابر با ۴ می شود. روش دیگر به دست آوردن آن، تقسیم الکترون های ظرفیتی کل به ۲ است.
در ادامه
در یک ترکیب به اتمی که بیشترین پیوند را دارد، اتم مرکزی گفته می شود که در این ترکیب اکسیژن به عنوان اتم مرکزی تعیین می شود.
با تعیین اتم مرکزی می توان ساختار یون را رسم کرد. بعد از بررسی قانون اکتت در اتم های تشکیل دهنده، بار هر اتم مشخص می شود. در یون هیدرونیوم، بار منفی روی اتم اکسیژن وجود دارد.
بعد از این که تمام الکترون ها در رسم ساختار ترکیب قرار داده شد، الکترون های باقی مانده را با نشانه گذاری از اتم های خارجی شروع می کنند. اما در یون مذکور، اتم بیرونی هیدروژن بوده و فقط دو الکترون می تواند داشته باشد، به همین دلیل بقیه الکترون ها را روی اتم اکسیژن قرار می دهند.
الکترون های ناپیوندی در هر ترکیب به صورت دو نقطه نشان داده می شود. اما بعد از رسم ساختارهای الکترونی، هر اتم باید به آرایش هشت تایی برسد.
خاصیت اسیدی هیدرونیوم
قدرت اسیدی یک ماده با کمک ثابتی به نام ثابت تفکیک اسیدی نشان داده می شود. ثابت تفکیک اسیدی را در تعریفی لگاریتمی به صورت pKa تعریف می کنند. یون هیدرونیوم در دمای ۲۵ درجه سانتی گراد، مقدار pKa برابر با ۱,۷- داشته که نشان دهنده قوی بودن این اسید است. یون هیدرونیوم به عنوان اسید مزدوج آب در نظر گرفته می شود. زیرا در تعریف آرنیوس، اسید یون پروتون از دست می دهد که در ترکیب با آب، یون هیدرونیوم را تشکیل می دهد.
محاسبه PH
یکی از کاربردهای غلظت یون پروتون با توجه به قدرت اسیدی که گفته شد، برای محاسبه میزان PH است. برای به دست آوردن این کمیت، از نسبت یون های هیدرونیوم و هیدروکسید استفاده می کنند. طبق رابطه زیر، PH از غلظت یون هیدرونیوم به دست می آید.
PH = -log [H+]
مولاریه واحد بیان کننده غلظت یون هیدروژن است. با مقدار PH می توان به قدرت اسیدی و بازی بودن یک ترکیب پی برد. مقدار عددی این کمیت بین ۰ تا ۱۴ است که PH = 7 به آب خالص نسبت داده می شود. وقتی غلظت یون هیدروژن بالا رود، با توجه به رابطه لگاریتمی مقدار عددی PH کم می شود و نشان دهنده اسیدی بودن یک ترکیب است. در صورتی که میزان غلظت یون هیدروژن بالا باشد، مقدار PH عدد بزرگتری شده و نشان دهنده بازی بودن یک ترکیب است.
با توجه به رابطه ای که گفته شد، مقدار غلظت یون هیدروژن از رابطه زیر به دست می آید.
[H۳O+] = ۱۰-PH
کاربرد هیدرونیوم
یکی از کاربردهای این یون در ترکیب محصولات مراقبت از پوست است. این محصولات می تواند یک لایه بردار و یا یک بازسازی کننده باشد. زیرا با کم کردن میزان PH، باعث نابودی سلول های مرده می شود. همچنین اگر این یون با مواد دیگر ترکیب شود برای درمان زخم ها و همچنین سوختگی مورد استفاده قرار می گیرد.



















