
در علم شیمی، واکنش خنثی شدن (Neutralization) به واکنش شیمیایی گفته می شود که در آن، یک اسید با یک باز (هیدروکسید فلزی) واکنش داده و نمک و آب تولید کند. از آنجاییکه در چنین واکنش هایی، خاصیت اسیدی و خاصیت بازی خنثی می شوند، به نام واکنش های خنثی شدن شناخته می شوند. جالب است بدانید که این نوع واکنش ها، به نام واکنش اسید و باز، واکنش خنثی سازی و یا خنثایش نیز مشهور هستند. توجه داشته باشید که در طی واکنش خنثی سازی، هیچ یون هیدروژن یا هیدروکسیدی در محلول باقی نخواهد ماند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی واکنش خنثی شدن و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
واکنش اسيد– باز
همانطور که بیان شد، واکنش خنثی شدن جهت واکنش میان یک اسید و یک باز استفاده می شود. به طور کلی، واکنش خنثی شدن را به شکل زیر نشان می دهند:
آب + نمک → باز + اسید
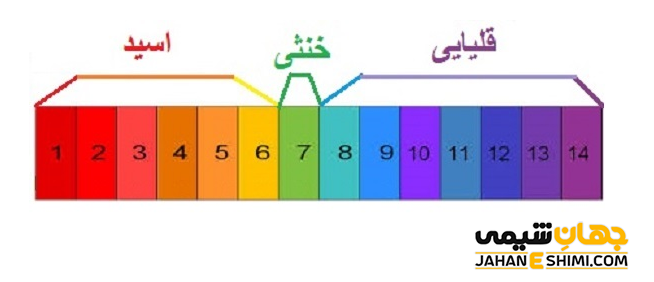
ترکیبات اسيدی و بازی، بخش بسیار مهمی از علم شيمی را تشکيل می دهند. يک اسيد در حقیقت ترکيبی است که زمانی در آب حل شود تفکیک می شود و يون پروتون آزاد می کند. در حاليکه، يک باز ترکيبی است که در زمان حل شدن در آب و تفکیک، يون هیدروکسید آزاد نماید. قدرت اسيدی و قدرت بازی یک ترکیب را می توان با pH مربوط به آن اندازه گيری کرد. ترکيباتی با pH کمتر از ۷، اسید و ترکيباتی با pH بیشتر از ۷، باز شناخته می شوند. دو معادله زير به ترتیب، تفکيک يک اسيد (HCl) و تفکیک یک باز (NaOH) را در محلول آبی نشان می دهند.
HCl (g) + H۲O → H+ (aq) + Cl– (aq)
NaOH (s) + H۲O → Na+ (aq) + OH– (aq)
دقت داشته باشید که در اسید های تک پروتونی قوی همچون HNO۳ یا HCl، غلظت یون هیدرونیوم با غلظت اسید برابر است. به طور مشابه، در باز های تک ظرفیتی یا همان هیدروکسید فلزات قلیایی مانند LiOH، NaOH، KOH، RbOH و CsOH، غلظت یون هیدروکسید برابر با مولاریته باز است. محلول این باز ها موادی خورنده محسوب می شوند که بیشتر به عنوان لوله بازکن بکار برده می شوند. علاوه بر آن، در محلول باز های قوی دو ظرفیتی مانند هیدروکسید کلسیم (Ca(OH)۲)، هیدروکسید استرانسیم (Sr(OH)۲) و هیدروکسید باریم (Ba(OH)۲)، غلظت یون هیدروکسید در حقیقت دو برابر غلظت باز خواهد بود.
واکنش خنثی شدن
همانطور که بیان شد رابطه کلی واکنش خنثی سازی به صورت کلی زیر نوشته می شود:
AH + B → A + BH
لازم به ذکر است که فلش یک طرفه به منظور نشان دادن واکنش های خنثی شدن مورد استفاده قرار می گیرد. زیرا در حقیقت این نوع از واکنش ها به طور کامل و یک طرفه انجام می شوند. به بیان ساده تر، واکنش خنثی سازی را می توان بر اساس نظریه اسید و باز لوری- برونستد تعریف کرد. همانطور که مشاهده می کنید، بار های الکتریکی در معادله بالا حذف شده اند. چون ممکن است هیچ یک از اجزای واکنش فوق، بار الکتریکی نداشته باشند. به عنوان مثال واکنش خنثی شدن زیر را در نظر بگیرید.
HCl (aq) + NaOH (aq) → NaCl (aq) + H۲O (l)
اين واکنش طی دو مرحله انجام می شود.
HCl (aq) + NaOH (aq) → H+ (aq) + Cl– (aq) + Na+ (aq) + OH– (aq) → NaCl (aq) + H۲O(l)
در مرحله اول اسید HCl و باز NaOH تفکيک می شوند. در مرحله دوم، یون های پروتون با یون های هیدروکسید واکنش داده و به مولکول های آب تبدیل می شوند. همچنین یون های کلر و سدیم نیز نمک NaCl تشکیل می دهند. نمک هایی که به وسيله واکنش های اسيد- باز ایجاد می شوند، خنثی هستند. این نمک ها، زمانیکه در آب حل شوند همچون يک الکتروليت عمل خواهند کرد. در این صورت هادی جریان الکتريسيته می باشند. جالب است بدانید که واکنش خنثی شدن در حقیقت نوعی واکنش گرماگیر محسوب می شود.

معادله واکنش های خنثی شدن
در مسائل مربوط به واکنش های خنثی سازی اسید- باز، از معادله زیر استفاده می کنند. در این معادله، یک طرف رابطه مربوط به اسید مربوطه و طرف دوم رابطه مربوط با باز مورد نظراست.
n۱M۱V۱ = n۲M۲V۲
علاوه بر آن می توان به کمک معادله زیر، غلظت مخلوط حاصل از دو محلول را محاسبه کرد.
pH واکنش خنثی شدن
واکنش هاd خنثی شدن کاملا به قدرت اسيد و باز بستگي دارند. به عبارت دیگر، اگر واکنشی میان يک اسيد قوی با يک باز قوی اتفاق بیفتد، pH واکنش برابر با هفت است. نتيجه این واکنش به طور یقین با واکنش میان يک اسيد قوی با يک باز ضعیف و يا واکنش بین يک اسيد ضعيف با يک باز قوی بسیار متفاوت خواهد بود. pH واکنش خنثی شدن میان یک اسید قوی و باز ضعیف، کمتر از ۷ خواهد بود. در حالیکه، واکنش خنثی شدن میان باز قوی با یک اسید ضعیف، pH بیشتر از هفت را می دهد.
انواع واکنش های خنثی شدن
واکنش میان اسید قوی با باز قوی
اسید قوی و باز قوی به اسید و بازی گفته می شود که به صورت کامل در محلول آبی تفکیک شوند. به عنوان مثال، هیدروکلریک اسید یک اسید قوی و هیدروکسید سدیم نیز نوعی باز قوی محسوب می شوند. از این جهت، وقتیکه یک اسید قوی با یک باز قوی وارد واکنش شود، واکنش خنثی شدن به شکل زیر خواهد بود:
H+ + OH− → H۲O
لازم به ذکر است که وقتی یک اسید قوی به وسیله یک باز قوی خنثی می گردد، هیچ یون پروتون یا هیدروکسید اضافی در محلول باقی نمی ماند. چنین محلولی خنثی بوده، بنابراین خاصیت اسیدی یا بازی ندارد. همانطور که قبلا بیان شد، pH این واکنش برابر با هفت و یا نزدیک به ۷ است.

واکنش میان اسید ضعیف با باز قوی
اسید ضعیف به اسیدی گفته می شود که به صورت کامل در آب تفکیک نمی شود، مانند اسید استیک. از این جهت واکنش حالت تعادلی خواهد داشت (فلش دو طرفه برای این نوع از واکنش ها استفاده می شود).
–AH + H۲O ⇌ H۳O+ + A
pH این واکنش به قدرت تفکیک اسید بستگی دارد (pKa). با استفاده از معادلات مربوط به محاسبات pH که در اینجا نیازی به بیانشان نیست، می توان مقدار pH را به کمک رابطه زیر بدست آورد.
pH ≈ ۱۲ (pKw + pKa – logTA)
در این رابطه، مقدار pH در نقطه پایانی تیتراسیون به طور کلی به pKa و غلظت اسید (TA) بستگی دارد. در واقع، با افزایش غلظت اسید، میزان pH در نقطه پایانی تیتراسیون، با شیب تندی افزایش می یابد. جالب است بدانید که در تیتراسیون یک اسید ضعیف با یک باز قوی، در pH بزرگتر از عدد ۷ به نقطه پایانی خواهید رسید. بنابراین توصیه می شود که از شناساگر هایی همچون فنول فتالئین بهره ببرید. زیرا این معرف در مقادیر بالای pHتغییر رنگ می دهد.

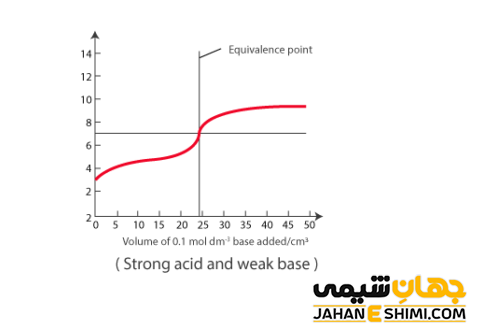
واکنش میان اسید قوی با باز ضعیف
این واکنش نیز مانند واکنش میان اسید ضعیف و باز قوی است. باز ضعیف به بازی گفته می شود که به صورت جزئی در آب تفکیک شود، مانند آمونیاک. به بیان دیگر، در محلول باز ضعیف علاوه بر مقدار کمی از یون های آبپوشیده، تعداد بسیار زیادی از مولکول های آمونیاک دست نخورده نیز پیدا می شود. محلول آمونیاک اغلب به عنوان شیشه پاک کن بکار برده می شود. جالب است بدانید که این واکنش نیز حالت تعادلی خواهد داشت.
H۳O+ + B ⇌ H۲O + BH
در اینجا، مقدار pH در نقطه پایانی تیتراسیون به pKa و pKb بستگی دارد. جالب است بدانید که در تیتراسیون یک اسید قوی با یک باز ضعیف، در pH کمتر از عدد ۷ به نقطه پایانی خواهید رسید. بنابراین توصیه می شود که از شناساگر هایی همچون متیل اورانژ بهره ببرید. زیرا این معرف در مقادیر پایین pHتغییر رنگ می دهد.
واکنش میان اسید ضعیف با باز ضعیف
وقتی که یک اسید ضعیف با یک باز ضعیف وارد واکنش شود، واکنش خنثی شدن به صورت کامل انجام نمی شود. به عبارت دیگر، هیچکدام از اسید ضعیف یا باز ضعیف، نمیت وانند همدیگر را به صورت کامل خنثی نمایند. در این مدل، غلظت ذرات در واکنش تعادلی مورد نظر به ثابت تعادل وابسته است.
+AH + B ⇌ A– + BH

کاربرد های واکنش خنثی شدن
از جمله کاربرد های واکنش خنثی شدن می توان به مواردی همچون تیتراسیون، صنایع کشاورزی، ضد اسید ها و غیره اشاره کرد.
تیتراسیون
تیتراسیون خنثی شدن در اندازه گیری غلظت آنالیت های معدنی، آلی و یا زیستی که خواص اسیدی یا بازی ذاتی دارند، یا اینکه بتوانند به کمک روش های مناسب و مختلف به چنین گونه هایی تبدیل شوند، مورد استفاده قرار می گیرد. اغلب عناصر غیر فلزی مانند کربن، گوگرد، نیتروژن، فلوئور، کلر، برم و چند گونه دیگر قابلیت این نوع تجزیه را دارند.

صنایع کشاورزی
در کود های کشاورزی و همچنین کنترل pH خاک، از واکنش های خنثی شدن استفاده می کنند. اگر محیط خاک بسیار اسیدی باشد، از کودهای قلیایی به منظور خنثی سازی بهره می برند.
شیره معده و ضد اسید ها
معده به منظور گوارش غذا، به محیط اسیدی نیاز دارد. اگر به هر دلیلی، مقدار اسید معده (HCl) بیش از اندازه شود، در اینصورت تعداد یون های پروتون جذب شده به وسیله سلول های دیواره معده نیز افزایش می یابد. بنابراین می تواند موجب درد، التهاب و یا حتی گاهی خونریزی معده گردد. یکی از راه های درمان که باعث کاهش درد معده می شود، استفاده از ضد اسید ها است. این دارو ها خاصیت بازی دارند (اغلب دارای سدیم بیکربنات هستند)، پس می توانند با اسید معده واکنش دهند و در نتیجه آن را خنثی کنند.



















