آنتالپی تشکیل – آنتالپی ذوب، تبخیر، تصعید، سوختن
به انرژی کل سیستم در دما و فشار ثابت آنتالپی می گویند. آنتالپی تشکیل به مقدار گرمایی که در یک واکنش شیمیایی با تبدیل مواد اولیه به محصولات واکنش مبادله می شود، می گویند. در این مقاله نشریه جهان شیمی فیزیک به تعریف آنتالپی واکنش، محاسبه و انواع آن (آنتالپی تبخیر، تصعید، ذوب و..) می پردازیم.
فهرست مطالب :
۱- تعریف آنتالپی تشکیل و تغییرات آنتالپی
۲- آنتالپی استاندارد تشکیل (ΔHf)
۳- تغییرات آنتالپی واکنش (ΔH)
۴- اندازه گیری آنتالپی واکنش
۵- محاسبه آنتالپی استاندارد واکنش (ΔH)
۶- آنتالپی تشکیل و تفکیک پیوند
۷- محاسبه آنتالپی واکنش با استفاده از انرژی های تفکیک پیوند مولی
۸- آنتالپی استاندارد تبخیر
۹- آنتالپی استاندارد ذوب
۱۰- آنتالپی استاندارد تصعید
۱۱- آنتالپی سوختن
۱- تعریف آنتالپی و تغییرات آنتالپی :
انرژی سیستم در دما و فشار ثابت آنتالپی است که طبق فرمول زیر تعریف می شود. در ترمودینامیک آنتالپی سیستم، انرژی کل سیستم منهای انرژی جنبشی و پتانسیل است. واحد آن درواحد بین المللی یکاها برحسب ژول می باشد.
H = E + PV
در این فرمول H آنتالپی بر حسب ژول، E انرژی درونی سیستم آن هم برحسب واحد ژول، P فشار بر حسب پاسکال و V حجم سیستم بر حسب واحد متر مکعب می باشد. پس آنتالپی انرژی گرمایی کل سیستم را نشان می دهد.
۲- آنتالپی استاندارد تشکیل (ΔHf) :
انجام یک واکنش تحت تاثیر خواص فیزیکی مواد واکنش دهنده و شرایطی که واکنش در آن انجام می شود است. به همین دلیل آنتالپی واکنش را در یک شرایط یکسان و ثابتی اندازه گیری می کنند تا شرایط متفاوت مشکلاتی در این اندازه گیری ایجاد نکند. این شرایط استاندارد فشار یک اتمسفر و دمای ۲۵ درجه سانتیگراد و خالص بودن مواد است. تغییرات آنتالپی واکنش شیمیایی که در آن یک مول ماده مرکب از عنصرهای تشکیل دهنده خود در شرایط استاندارد به دست می آید را آنتالپی تشکیل استاندارد می گویند. به عنوان مثال وقتی یک مول دی اکسید کربن در شرایط استاندارد از یک مول کربن و یک مول اکسیژن ساخته می شود، مقدار گرمای مبادله شده را آنتالپی تشکیل استاندارد دی اکسید کربن می گویند.
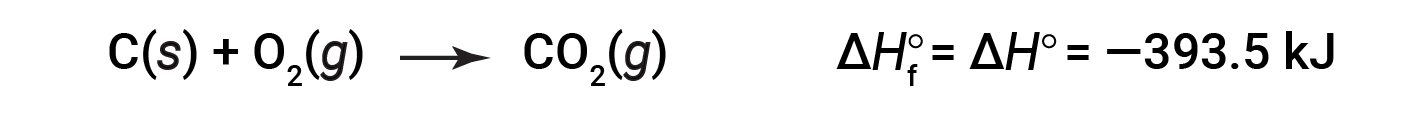
نکته :
آنتالپی تشکیل استاندارد هر عنصر در حالت پایدار صفر در نظر گرفته می شود. مثلا اکسیژن در حالت پایدار که به شکل دو اتمی است و هیدروژن در حالت پایدار H۲ آنتالپی تشکیل صفر دارند.
۳- تغییرات آنتالپی واکنش (ΔH) :
یک واکنش شیمیایی از واکنش دهنده ها (باهم ترکیب می شوند) و محصولات تشکیل شده است. در این حین مقداری انرژی به صورت گرما یا به شکل های دیگر مبادله می شود. به این دلیل که همیشه مقدارهای مشخصی مواد واکنش دهنده به فرآورده تبدیل شده و انرژی آن ها باهم برابر نیست، پس هر واکنشی با تبادل انرژی همراه است.
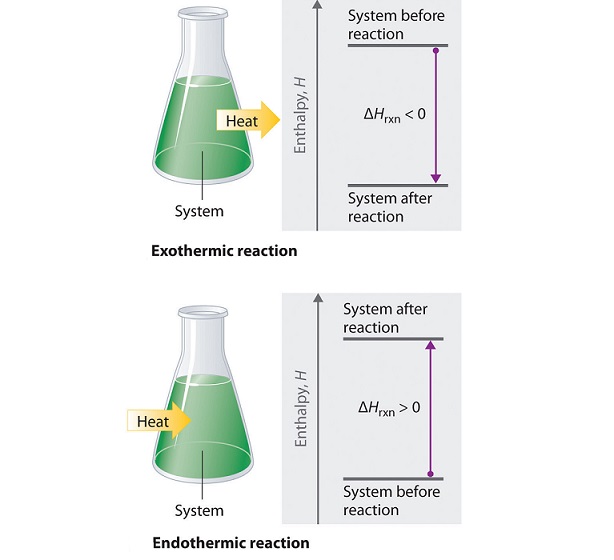
به مقدار گرما و انرژی که در طی انجام یک واکنش شیمیایی و تبدیل مواد اولیه به محصولات واکنش مبادله می شود تغییرات آنتالپی می گویند. تغییرات آنتالپی در دستگاه های آنالیز تعیین می شود و به آن آنتالپی واکنش نیز می گویند. آنتالپی واکنش ها می تواند صفر، مقدار مثبت (واکنش های گرماگیر) و یا مقدار منفی (واکنش های گرماده) داشته باشد. با استفاده از قانون هس می توان آنتالپی واکنش ها را حساب کرد.
۴- اندازه گیری آنتالپی واکنش :
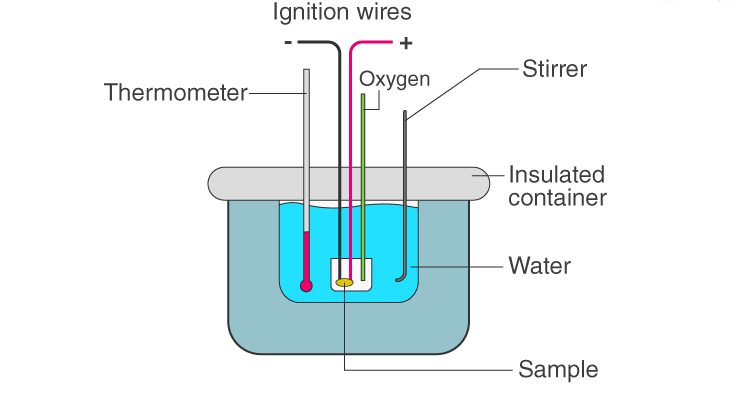
به طور غیر مستقیم آنتالپی یک واکنش را از کالریمتری سنجشی مقیاسی به دست می آورند. در روشی مستقیم از کالریمتر ساده استفاده می کنند. اگر کالریمتر در اختیار نباشد می توان با استفاده از دو بشر بزرگ و کوچک که بین آن ها از مواد عایق پر شدهريا، یک کالریمتر ساخت و گرمای واکنش را محاسبه کرد. اگر بر اثر انجام واکنش، آنتالپی افزایش یابد واکنش گرماگیر و علامت ΔH مثبت و اگر آنتالپی واکنش کاهش یابد، واکنش گرماده بوده و علامت ΔH منفی خواهد بود.
۵- محاسبه آنتالپی استاندارد واکنش (ΔH) :
با استفاده از آنتالپی استاندارد تشکیل مولی مواد :
تغییرات آنتالپی هر واکنشی را می توان با استفاده از آنتالپی تشکیل مولی تمام مواد شرکت کننده در واکنش و محصولات آن ها به دست آورد. آنتالپی تشکیل مولی هر ماده ای باید در شرایط استاندارد باشد. واکنش کلی زیر را در نظر می گیریم:
aA + bB → cC + dD
حروف بزرگ نشان دهنده مواد واکنش و حروف کوچک ضرایب استوکیومتری مواد هستند. تغییر آنتالپی این واکنش برابر است با :
ΔH = ∑ ΔHf (products) _ ∑ ΔHf (reactants) = (c ₓ ΔHfc + d ₓ ΔHfd + …) _ (a ₓ ΔHfa + b ₓ ΔHfb + …)
یعنی از مجموع حاصل ضرب آنتالپی تشکیل مولی محصولات در ضرایب آن ها منهای مجموع حاصل ضرب آنتالپی تشکیل مولی مواد اولیه در ضرایب آن ها، تغییر آنتالپی واکنش به دست می آید. فقط نکته ای که باید در نظر گرفته شود این است که آنتالپی تشکیل مولی عناصر در حالت استاندارد صفر است.
۶- آنتالپی تشکیل و تفکیک پیوند :
وقتی یک پیوند A-B را داریم، تغییر آنتالپی برای تشکیل این پیوند از A و B را در شرایط استاندارد، آنتالپی تشکیل پیوند گویند. در همان پیوند، آنتالپی تفکیک پیوند، تغییر آنتالپی برای گسستن پیوند به گونه های تشکیل دهنده آن A و B را گویند. آنتالپی تفکیک پیوند برابر با آنتالپی تشکیل آن با علامت مخالف است.
ΔHA-B = _ ΔHf (A-B)
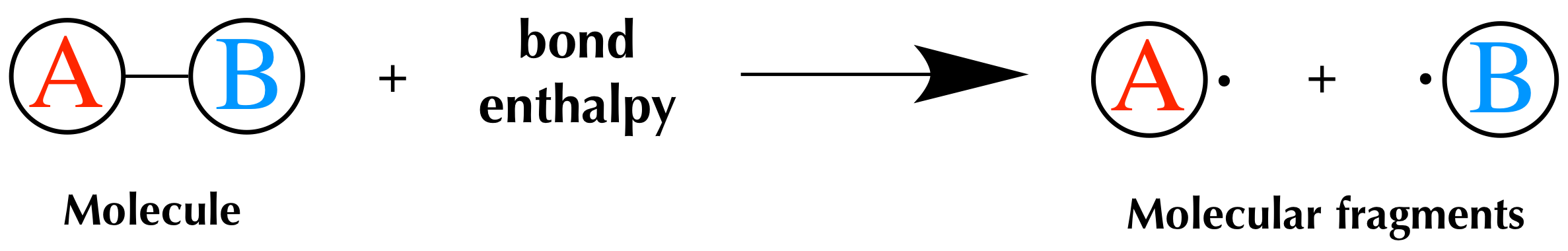
برای شکستن پیوندها انرژی مصرف می شود علامت ΔH مثبت است و تشکیل پیوند انرژی آزاد کرده و علامت ΔH منفی است.
۷- محاسبه آنتالپی واکنش با استفاده از انرژی های تفکیک پیوند مولی :
همان طور که می دانیم وقتی یک واکنش شیمیایی می خواهد اتفاق بیفتد، ابتدا پیوند بین اتم های واکنش دهنده ها شکسته شده پیوند جدیدی تشکیل می دهند که باعث به وجود آمدن محصولات واکنش است. برای شکستن پیوندها انرژی مصرف می شود و تشکیل پیوند انرژی آزاد می کند. اگر انرژی آزاد شده بیشتر از انرژی مصرف شده باشد، واکنش گرماده و برعکس اگر انرژی مصرف شده بیشتر از انرژی آزاد شده باشد واکنش گرما گیر است.
برای محاسبه تغییر آنتالپی یک واکنش می توانیم از انرژی تفکیک پیوند مواد طبق فرمول زیر استفاده کنیم.
ΔH = ∑ ΔHbreaking _ ∑ ΔHmaking
به عبارت دیگر از مجموع انرژی های پیوند مواد اولیه (شکستن پیوند) منهای مجموع انرژی های پیوند محصولات تغییر آنتالپی واکنش به دست می آید.
نکته :
در این روش محاسبه تمام مواد اولیه و محصولات واکنش باید در حالت گازی شکل باشند، چون در کل برای تعریف انرژی تفکیک پیوند مواد را در حالت گازی داریم.
روش دیگری برای محاسبه تغییر آنتالپی واکنش وجود دارد که در آن تغییر آنتالپی واکنش از تغییر آنتالپی سوختن مولی مواد اولیه منهای تغییر آنتالپی مولی سوختن محصولات به دست می آید. این روش بیشتر برای مواد آلی و قابل سوختن در اکسیژن به کار گرفته می شود.
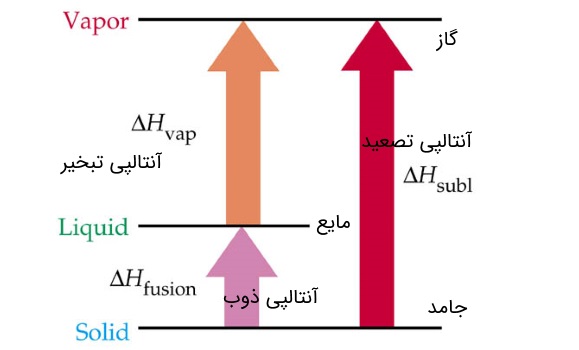
۸- آنتالپی استاندارد تبخیر :
در کل وقتی در یک سیستم مواد از یک حالت فیزیکی (فاز) به حالتی دیگر تبدیل می شوند، بخشی از انرژی سیستم برای این تغییر فاز مصرف می شود. در این واکنش ها هنگام تغییر فاز، دما ثابت است.
مقدار گرما و انرژی لازم برای این که یک مول مایع در دمای معین (نقطه جوش) به حالت بخار تبدیل شود را آنتالپی استاندارد تبخیر یا همان گرمای نهان تبخیر می گویند. چون فرآیند تبخیر گرماگیر است آنتالپی استاندارد تبخیر برای همه مواد مثبت است.
این انرژی برای غلبه بر نیروهای جاذبه و انبساط گاز حاصل مصرف می شود. پیوند بین گونه ها باید به طورکامل شکسته شده و به فاز بخار بروند. با افزایش فشار آنتالپی تبخیر کم می شود.
۹- آنتالپی استاندارد ذوب :
تغییر آنتالپی وقتی یک مول ماده جامد در دمای معین (نقطه ذوب)، به حالت مایع تبدیل می شود را آنتالپی استاندارد ذوب یا همان گرمای نهان ذوب می گویند. گرمای نهان ذوب با گرمای انجماد از نظر عددی برابر ولی با علامت مخالف است. انرژی که در ذوب جامدات استفاده می شود صرف سست کردن پیوند بین گونه ها می شود تا به شکل مایع درآمده و آزادی حرکت بیشتری داشته باشند. ولی در تبخیر انرژی مصرفی هم برای گسستن کامل پیوندها و هم انبساط گاز استفاده می شود، به این دلیل گرمای نهان ذوب یک ماده همیشه کمتر از گرمای نهان تبخیر آن است.
۱۰- آنتالپی استاندارد تصعید :
تصعید فرآیندی است که در آن یک ماده جامد از فاز جامد به طور مستقیم (بدون عبور از حالت مایع) به فاز بخار تبدیل می شود. به تغییر آنتالپی در فرآیند تصعید برای یک مول ماده جامد در حالت استاندارد آنتالپی استاندارد تصعید که برحسب واحد کیلو ژول بر مول بیان می شود، می گویند.
۱۱- آنتالپی سوختن :
به تغییرات آنتالپی واکنشی که در آن یک مول ماده در اکسیژن کافی می سوزد و تولید CO۲ و H۲O می کند، آنتالپی سوختن می گویند. اگر ترکیب آلی حاوی نیتروژن باشد، به N۲ اکسید می شود. هرچه جرم مولی ماده بیشتر باشد آنتالپی سوختن مقدار بیشتری خواهد داشت.



















