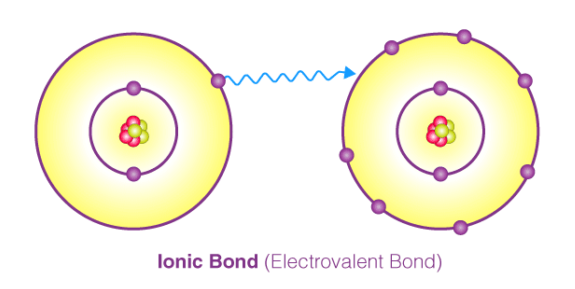
پیوند یونی (Ionic Bond) یا پیوند الکترووالانسی (Electrovalent Bond) یکی از انواع پیوندهای شیمیایی می باشد. این پیوند از انتقال الکترون بین اتم های درگیر در پیوند ایجاد می شود و در آن، اتم ها به صورت یون های منفی و مثبت در می آیند. در واقع در این نوع پیوند، یون های مثبت و منفی با نیروی جاذبه الکتروستاتیک قوی در ساختار بلور در کنار هم قرار می گیرند. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با پیوند یونی ارائه شده است. لطفا همراهی بفرمایید.
فهرست مطالب
تعریف پیوند یونی
پيوند يونی به دلیل جاذبه الکتروستاتیک بين يون های غیر همنام (كاتيون و آنيون) تشکیل می شود. در این پیوند انتقال الكترون بین یک اتم یا مجموعه ای از اتم هایی که با پیوند کووالانسی به هم متصل اند انجام می شود. به انتقال الکترون در بین اتم ها، الکترووالانس (Electrovalence) گفته می شود که می توان گفت مقابل مفهوم کووالانس (Covalent) می باشد.
دلیل انجام پیوند های یونی این است که اتم ها تمایل دارند که با رسیدن به آرایش گاز های نجیب (قاعده اکتت) به ساختار پایدار دست یابند. اتم هایی که در لایه ظرفیت خود تعداد کمی الکترون دارند، می توانند آن الکترون ها را به راحتی از دست بدهند و در مقابل اتم هایی که لایه ظرفیت شان تقریبا پر می باشد می توانند الکترون جذب نمایند. در این صورت هر دو اتم شرکت کننده در پیوند دارای یک لایه ظرفیت پر (هشت تایی) خواهند شد.
در تشکیل پيوند الکترووالانسی معمولا یک اتم الکترون گرفته و اتم دیگر آن الکترون را از دست می دهد، اما ممکن است مجموعه اي از اتم ها، الكترون بگيرند یا از دست بدهند. در واقع كاتيون ها و آنيون ها مي توانند تك اتمي و یا چند اتمي باشند. به عنوان مثال کاتیون +Mg۲، یک کاتیون تک اتمی است در حالیکه +Hg۲۲ یک کاتیون دو اتمی و +NH۴ یک کاتیون پنج اتمي محسوب می شود. یا مثلا –F یک آنیون تک اتمی است، اما آنیون های –SO۴۲ و –C۲H۳O چند اتمی می باشند.
تشکیل پیوند یونی
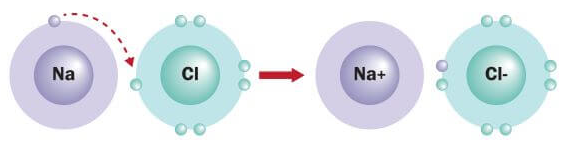
پيوند الکترووالانسی می تواند بين فلزات و نافلزات با یکدیگر (مانند FeCl۲ که متشکل از یون های +Fe۲ و –Cl است)، بین دو نافلز (مانند PCl۵ كه متشكل از يون های +PCl۴ و –PCl۶ است) و یا حتی بین دو فلز (مانند CsAu كه متشكل از يون هاي –Au و +Cs است) تشکیل شود. اما معمولا عناصر غیر فلزی با یکدیگر پيوند كووالانسی و عناعر فلزی با یکدیگر پيوند فلزی تشکیل می دهند.
بنابراين می توان گفت که پيوند الکترووالانسی به طور معمول بين فلزات و نافلزات تشکیل مي شود. زیرا تمایل زیاد فلزات به از دست دادن الکترون و همچنین تمايل بالای نافلزات برای گرفتن الكترون سبب سهولت در ايجاد يون ها مثبت و منفی و در نتیجه تشکیل پیوند یونی می گردد.
در هنگام تشکیل پیوند الکترووالانسی، فلزات (دارای یک تا گاهی اوقات ۴ الکترون در لایه والانس) با از دست دادن الکترون های لایه ظرفیت خود به یون مثبت (کاتیون) تبدیل می شوند و اغلب به آرایش گاز نجیب قبل از خود دست می یابند. اما نا فلزات (دارای چهار تا هفت الکترون در لایه والانس) با گرفتن الکترون به یون منفی (آنیون) تبدیل می شوند و به آرایش گاز نجیب بعد از خود دست می یابند. با انتقال الکترون، تعداد الکترون ها دیگر با بار هسته مطابقت نمی کند. بنابراین اتم ها از لحاظ الکتریکی خنثی نبوده و دارای بار های مختلفی خواهند بود.
عوامل موثر بر قدرت پیوند یونی
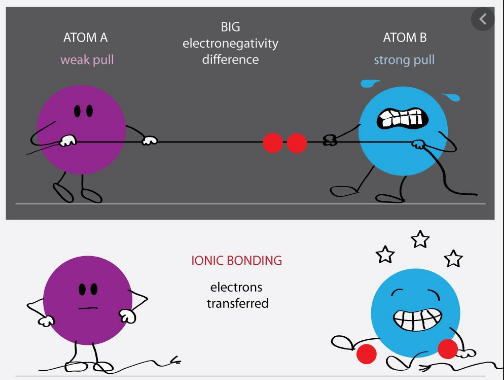
به طور کلی پیوند الکترووالانسی میان اتم هایی که اختلاف الکترونگاتیویته بین آنها زیاد باشد (حدود ۱/۷ و یا بیشتر) تشکیل می شود. توجه داشته باشید که پیوند الکترووالانسی خالص (کاملا یونی) نداریم، زیرا در هر پیوند یونی درجه ای از پیوند کووالانسی هم وجود دارد. بنابراین یک پیوند را زمانی الکترووالانسی در نظر می گیریم که خاصیت یونی بودن آن پیوند بیشتر از خاصیت کووالانسی اش باشد. هر چه اختلاف الکترونگاتیویته بین اتم های درگیر در پیوند یونی، بیشتر باشد آن پیوند یونی تر، در نتیجه قوی تر می باشد.
همان طور که می دانید، فلزات الکترونگاتیویته کم و نافلزات الکترونگاتیویته زیادی دارند، بنابراین پیوند الکترووالانسی میان عناصر فلزی (عناصر الکتروپوزتیو قوی) و غیر فلزی (عناصر الکترونگاتیو قوی) تشکیل می شود. در این صورت فلزات الکترون از دست داده و نا فلزات الکترون می گیرند.
از طرف دیگر اندازه و بار یون های شرکت کننده در پیوند الکترووالانسی نیز در قدرت پیوند تاثیر دارند. هرچه اندازه یون های شرکت کننده در پیوند کوچکتر باشد و بار یون ها نیز بیشتر، پیوند یونی تشکیل شده قوی تر میگردد. در اینصورت جدا کردن یون ها از یکدیگر سخت تر میشود و انرژی شبکه ترکیب یونی حاصله بیشتر می باشد.
گروه های شرکت کننده در پیوندهای یونی
عناصر گروه اول (فلزات قلیایی) تنها یک الکترون در لایه ظرفیت خود دارند. زمانیکه هر یک از این فلزات یک الکترون را از دست بدهند تا لایه خارجی آنها کامل شود، جز باقیمانده به آرایش گاز نجیب متناظر خود دست پیدا می کند. به عنوان مثال لیتیم با از دست دادن یک الکترون آرایش گاز نجیب هلیم را پیدا کرده و تبدیل به کاتیون +Li می شود.
عناصر گروه دوم (فلزات قلیایی خاکی) و عناصر گروه سوم به ترتیب دو و سه الکترون در لایه ظرفیت خود دارند. بنابراین اتم های این فلزات باید دو و یا سه الکترون از دست بدهند تا لایه خارجی آنها کامل شود، بنابراین کاتیون های دو بار مثبت و سه بار مثبت ایجاد می کنند (مانند +Ca۲ و +Al۳). کاتیون های ایجاد شده آرایش الکترونی یکسان با گاز نجیب متناظر را دارند. عناصر فلزات واسطه نیز با از دست دادن الکترون می توانند در پیوند یونی شرکت کنند.
عناصر گروه ششم (کالکوژن ها) و عناصر گروه هفتم (هالوژن ها) به ترتیب شش و هفت الکترون در لایه ظرفیت خود دارند. اتم های این عناصر غیر فلزی با گرفتن دو و یا یک الکترون از فلزات، ساختار گاز نجیب را پیدا می کنند و پایدار می شوند (مانند آنیون های –O۲ و –F).
اما ذکر یک نکته درباره فلزات مهم می باشد. فلزات بریلیم و بور که سرگروه گروه های دوم و سوم جدول تناوبی می باشند توانایی تشکیل پیوند الکترووالانسی را ندارند. این دو فلز شعاع بسیار کوچکی دارند، بنابراین لایه ظرفیت به هسته اتم بسیار نزدیک بوده و هسته اجازه از دست دادن الکترون های لایه والانس و تشکیل کاتیون را نمی دهد. در واقع این دو فلز به دلیل کوچک بودن تحمل بار مثبت را ندارند. بنابراین تنها می توانند الکترون ها را به اشتراک گذاشته و در نتیجه ترکیبات کووالانسی و نه ترکیبات یونی را تشکیل دهند.
از طرفی دیگر توجه داشته باشید که عنصر آلومینیوم تنها با آنیون های اکسیژن، فلور و سایر آنیون های اکسیژن دار ترکب یونی تشکیل می دهد. همچنین اگر توجه کرده باشید در گروه های بالا از عناصر گروه چهارم جدول تناوبی صحبتی نشده است. زیرا ترکیبات عناصر گروه چهارم مانند کربن و سیلیسیم، کووالانسی می باشند.
ویژگی های پیوند یونی علوم نهم
پیوند یونی یک پیوند شیمیایی است که از انتقال الکترون بین اتم ها و ایجاد یون های باردار ایجاد می شود. فلزات برای تبدیل شدن به کاتیون، الکترون خود را از دست می دهند، در حالی که غیرفلزات برای تبدیل شدن به آنیون، الکترون می گیرند. جاذبه الکترواستاتیک حاصل پیوند یونی را تشکیل می دهد. ترکیبات یونی به دلیل ساختار کریستالی، نقطه ذوب و جوش بالا و توانایی رسانایی الکتریسیته در زمان حل شدن یا ذوب شدن شناخته شده اند. ساختار شبکه این ترکیبات با اندازه و بارهای یون ها تعیین می شود و قدرت پیوندها با انرژی شبکه اندازه گیری می شود. پیوندهای یونی همچنین می توانند ویژگی های کووالانسی را از خود نشان دهند که بر خواص ترکیب تأثیر می گذارد. پیوندهای یونی در ساختار ترکیبات بسیار مهم هستند و یکی از سه نوع اصلی پیوندهای شیمیایی هستند که بقیه پیوندهای کووالانسی و فلزی هستند. ویژگی های ترکیبات یونی
- حالت فیزیکی: این ترکیبات معمولاً در حالت جامد وجود دارند.
- ساختار کریستالی: یون ها در یک الگوی منظم در فضای سه بعدی قرار گرفته اند تا یک شبکه تشکیل دهند. با این حال، الگوی آرایش به اندازه و بارهای یون ها بستگی دارد.
- نقطه ذوب و جوش بالا: ترکیبات یونی دارای نقطه ذوب و جوش بالایی هستند. این به این دلیل است که یونها توسط نیروهای جاذبه الکترواستاتیکی قوی به هم متصل میشوند و از این رو، انرژی زیادی برای شکستن شبکه کریستالی مورد نیاز است.
- حلالیت: ترکیبات الکتریکی در حلال هایی مانند آب محلول هستند که طبیعت قطبی دارند و ثابت دی الکتریک بالایی دارند.
- رسانایی الکتریکی: ترکیبات یونی رسانای خوبی برای الکتریسیته در محلول یا در حالت مذاب هستند.
تفاوت پیوند یونی و کووالانسی
پیوند یونی و پیوند کووالانسی دو نوع پیوند شیمیایی هستند که از نظر ماهیت، ویژگیها و خواص فیزیکی تفاوت های زیادی باهم دارند. در پیوند یونی، یکی از اتم ها الکترون خود را از دست داده و به کاتیون مثبت تبدیل می شود، اتم دیگر (معمولاً غیر فلز) الکترون را دریافت کرده و به آنیون منفی تبدیل خواهد شد. در واقع این پیوند به دلیل نیروی جاذبه الکترواستاتیک بین کاتیون ها و آنیون ها شکل می گیرد.
پیوند کووالانسی زمانی رخ می دهد که دو اتم غیر فلز الکترون های خود را به اشتراک می گذارند. ترکیبات یونی معمولاً در دماهای بالا جامد بوده و در آب قابلیت انحلال دارند. آنها در حالت ذوب نیز هادی الکتریسیته هستند. ترکیبات کووالانسی در دماهای پایین معمولا به صورت مایع یا گاز هستند و عموماً رسانای الکتریسیته نیستند. در نهایت باید بدانید که پیوند یونی معمولاً به دلیل تفاوت زیاد الکترونگاتیویته بین اتمها قطبی است، در حالیکه پیوند کووالانسی ممکن است قطبی یا غیرقطبی باشد.



















