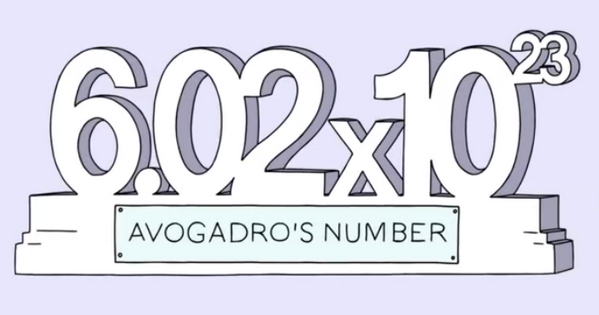
عدد آووگادرو یا ثابت آووگادرو که با نماد NA نشان داده می شود، در واقع بین ذرات تشکیل دهنده ماده و مقدار آن ماده ارتباط برقرار می کند. به بیانی دیگر، عدد آووگادرو تعداد ذرات یک ماده (مولکول ها، اتم ها، یون ها، الکترون ها و یا سایر ذرات) را در یک مول از آن ماده محاسبه می کند. این عدد به یاد دانشمند مشهور ایتالیایی، آمادئو آووگادرو (Amedeo Avogadro) نامیده شده است. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با عدد آووگادرو ارائه می شود. لطفا با ما همراه باشید.
تعریف عدد آووگادرو چیست
عدد آووگادرو به تعداد ذرات یک ماده در یک مول از آن ماده گفته می شود. در واقع این عدد می گوید : هر مول از یک ماده شامل ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ ذره از آن ماده می باشد. توجه داشته باشید که ثابت آووگادرو با توجه به معنی مول به صورت mol−۱ ۶.۰۲۲۱۴۰۷۶×۱۰۲۳ تعریف شده است. معمولا ثابت آووگادرو در محاسبات تا سه رقم با معنی و به صورت ۱۰۲۳×۶.۰۲ نشان داده می شود.
ذرات بیان شده در پاراگراف بالا بسته به ماده شیمیایی مورد نظر متفاوت می باشند. به عنوان مثال عدد آووگادرو می تواند تعداد مولکول های موجود در یک مولکول گرم، تعداد اتم های موجود در یک اتم گرم و یا حتی تعداد الکترون های موجود در یک مول الکترون باشد. در ادامه این مقاله هر یک از این موارد را جداگانه بررسی خواهیم کرد.
برای اینکه مفهوم ثابت آووگادرو را بهتر متوجه شوید می توان گفت، همان طور که یک دست بشقاب شامل شش عدد بشقاب و یا یک دوجین جوراب شامل دوازده عدد جوراب می باشد، یک مول نیز شامل ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ از یک چیز است. این یک چیز می تواند مولکول، اتم، یون و یا الکترون باشد. مثلا اگر بخواهید تعداد ذرات را در ۵ مول از یک ماده پیدا کنید، کافیست که عدد ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ را در عدد ۵ ضرب نمایید:
۶.۰۲۲۱۴۰۷۶×۱۰۲۳ ×۵ = ۳.۱۶×۱۰۲۴
چگونه عدد آووگادرو به این نام شناخته شد؟
همانطور که گفته شد، واژه ثابت آووگادرو به افتخار دانشمند ایتالیایی انتخاب شد. در واقع آووگادرو سعی داشت تا دنیای میکروسکوپی و ماکروسکوپی را به هم مرتبط سازد. در این صورت علم شیمی وارد فاز جدیدی می شد که از طریق آن می توانست مقدار ماده را بر پایه و اساس شیمی محاسبه کرد. نکته جالب توجه این است که عدد آووگادرو توسط شخص آمادئو آووگادرو کشف نشده است. در واقع مقدار عددی این ثابت هیچ وقت توسط آقای آووگادرو بیان نشد.

در سال ۱۹۰۹ برای اولین بار ژان باتیست پرن (Jean Baptiste Perrin) به پاس بررسی رفتار گازها بر حسب تعداد مولكول های واكنش دهنده که توسط آووگادرو انجام شده بود در مقاله خود به نام حركت برآوني و واقعيت مولكولي (Movement and Molecular Reality) از این ثابت نام برد. پرين در مقاله خود بیان کرد كه اين عدد ثابت (N)، یک ثابت جهاني می باشد و بهتر است آن را ثابت آووگادرو در نظر بگيريم. در ادامه مقاله خواهید فهمید که چگونه دانشمندان عدد آووگادرو را تخمین زدند، اما قبل از آن به بررسی قانون آووگادرو می پردازیم.

قانون آووگادرو (فرض آووگادرو یا اصل آووگادرو)
زمانیکه آووگادرو در سال ۱۸۱۱ فرضیه خود را پیشنهاد داد، اطلاعات بسیار کمی در مورد اتم ها و مولکول ها وجود داشت. وی برای اولین بار متوجه شد که تعداد ذرات موجود در واحد حجم کلیه گازها در دما و فشار ثابت و معین، مقداری ثابت و برابر می باشد. این فرضیه بعد ها برای بزرگداشت این دانشمند به قانون آووگادرو معروف شد.
امروزه می دانیم که منظور از ذرات در پاراگراف بالا مولکول می باشد. در واقع می توان گفت که دو نمونه از گاز کامل که دارای فشار، دما و حجم یکسانی باشند، مطمئنا تعداد مولکولهای یکسانی نیز خواهند داشت. به عنوان مثال ده لیتر گاز اکسیژن را در نظر بگیرید. این ده لیتر گاز همان تعداد مولکول O۲ دارد که ده لیتر گاز متان در همان دما و فشار مولکول CH۴ دارد. به عبارت دیگر در شرايط يكسان، حجم مولی گاز به تعداد مولكول هاي آن بستگی دارد نه به جنس گاز.
قانون آووگادرو در واقع یک قانون میان گازها می باشد. این قانون را می توان به صورت ریاضی بیان کرد :
که در آن V حجم گاز، n مقدار ماده گاز و k یک عدد ثابت است. با توجه به معادله مشخص می شود که مقدار عدد ثابت برای تمام گازها یکسان است، که به ثابت عمومی گازها مشهور می باشد.

پیامدهای قانون آووگادرو
- در دما و فشار یکسان و برابر، حجم یک مول از گاز های گوناگون با هم برابر است.
- در شرایط استاندارد، جرم های برابر از گاز ها، حجم های یکسانی دارند.
- در شرایط استاندارد، یک مول از هر گاز حجمی (حجم مولی) برابر ۲۲/۴ لیتر دارد.
- در شرایط استاندارد، یک گرم از هر گاز حجمی برابر ۲۲۴۰۰ میلی لیتر دارد.
- در دما و فشار ثابت، اگر مقدار گاز زیاد شود، حجم آن افزایش می یابد.
- در دما و فشار ثابت، اگر مقدار گاز کم شود، حجم آن کاهش می یابد.
عدد آووگادرو چگونه محاسبه شد؟
عدد آووگادرو از زمانیکه مطرح شد، به کمک روش های مختلف توسط دانشمندان و محققان تعیین شده است. اولین مقدار تقریبی تعیین شده برای تعداد ذرات در نمونه ای مشخص، توسط دانشمند برجسته اتریشی به نام یوهان یوزف لوشمیت (Johann Josef Loschmidt) بیان شد. وي با استفاده از نظریه جديد جنبش مولكولي تعداد مولكول هاي موجود در هر سانتي متر مكعب از گاز در شرايط استاندارد را محاسبه کرد.

در واقع لوشمیت توانست تعداد ذرات موجود در یک حجم مشخص از گاز را تخمین بزند. این مقدار ( ۱۰۲۵×۲.۶۸۶۷۸۱۱) که امروزه به افتخار تلاش های لوشمیت، با نام ثابت لوشمیت (Loschmidt constant) شناخته و با نماد L نشان داده می شود.
توجه داشته باشید که ثابت آووگادرو و ثابت لوشمیتز بسیار به هم نزدیکند، بنابراین نباید این دو عدد را با هم اشتباه گرفت. ارتباط ثابت لوشمیت (n۰) با ثابت آووگادرو (NA) به کمک معادله زیر نشان داده می شود :
که در آن P۰ فشار گاز، R ثابت گازها و T۰ دمای مطلق است.
روش های تعیین عدد آووگادرو
مقدار عدد آووگادرو به کمک روش های الكترو شیمی و بلور شناسی محاسبه شده است. در روش بلور شناسی، یك عنصر را در نظر گرفته و با دستگاه های بسیار دقیق ساختار عنصر، سلول واحد بلور آن، وزن اتمی عنصر و وزن حجمی آن عنصر را محاسبه می کنند. بعد از مشخص شدن داده های ذکر شده و با كمك یك عملیات ریاضی میتوان عدد آووگادرو را به دست آورد.
در روش الكترو شیمی، ثابت فارادای را بر بار یک الکترون تنها تقسیم کرده و از این طریق مقدار عددی ثابت آووگادرو تعیین می شود. یک فارادی در واقع به بار یک مول از الکترون ها، گفته می شود که توسط رابرت میلیکان (Robert Millikan) تخمین زده شد.
به بیان دیگر، جریان الکترون ها و زمان را به کمک یک سلول الکتروشیمی اندازهگیری می کنند. در این حالت تعداد الکترون هایی که از سلول الکتروشیمی گذشته اند مشخص می شود. در نهایت تعداد اتم های یک نمونه با وزن مشخص را با جریان الکترون ربط داده و به وسیله آن عدد آووگادرو را محاسبه می کنند.
با گذشت زمان، دانشمندان رشته های شیمی و فیزیک از روش های دقیق تری برای تخمین عدد آووگادرو و صحت آن استفاده کردند. از جمله این آزمایشات می توان به پراکندگی نور توسط ذره ریز، برقکافت و کشسانی گازها، حرکت براونی، پراکندگی پرتوهای ایکس توسط بلورها و تابش جسم سیاه اشاره کرد. امروزه از پراش پرتو ايكس در فاصله شبكه اي فلزات و نمك ها استفاده می شود و جديدترين مقدار برای ثابت آووگادرو بدست آمده است.
اهمیت عدد آووگادرو
عدد آووگادرو در فهم تشکیل مولکول ها و واکنش میان آنها تاثیر به سزایی داشت. در سطوح اتمی و مولکولی، مواد در واحد جرم اتمی (amu یا u) سنجیده میشوند. متاسفانه در آزمایشگاه نمی توان با واحد جرم اتمی کار کرد، زیرا این واحد بسیار کوچک است و ترازو ها معمولا بر اساس گرم می باشند. در اینجا ثابت آووگادرو به کمک محققین آمد. در واقع ثابت آووگادرو جرم اتم ها را به عددی که قابل فهم باشد تبدیل کرد.
واحد جرم اتمی چیست؟
این واحد به عنوان یک دوازدهم جرم یک اتم کربن-۱۲ خنثی (معمول ترین ایزوتوپ کربن) که در حالت پایه و در حال سکون قرار دارد تعریف شده است. دلیل انتخاب اتم کربن این بود که : اتم کربن-۱۲ دارای ۶ پروتون، ۶ نوترون و ۶ الکترون می باشد. همانطور که می دانیم جرم الکترون ها بسیار کم است، بنابراین یک دوازدهم جرم یک اتم کربن-۱۲ بسیار نزدیک به جرم یک پروتون یا نوترون تنها خواهد بود. به عنوان نمونه، اتم هیدروژن به طور متوسط دارای جرم اتمی برابر با amu ۱/۰۰۷۹۴ می باشد.
متاسفانه، شیمیدانان مقیاسی برای اندازه گیری واحد های جرم اتمی نداشتند. بنابراین به دنبال راهی بودند تا بتوانند دنیای نامرئی اتم ها و مولکول ها را به دنیای ذرات شیمی که توسط مقیاس ها و اندازه گیری ها (بر حسب گرم) متصل کنند. برای این کار از ضریب تبدیل زیر استفاده کردند :
۱ amu = 1.66×۱۰-۲۴ grams
در واقع شیمیدانان با کمک این رابطه توانستند واحد نامرئی (اتم و مولکول) را به واحد قابل اندازهگیری (گرم) تبدیل کنند. این تبدیل، به کمک ثابت آووگادرو میسر شد. این رابطه نشان می دهد که اگر مقدار عدد آووگادرو یا یک مول از اتم های کربن-۱۲ داشته باشیم (بر طبق تعریف، جرم اتمی برابر با amu12 دارد)، دارای وزن دقیق ۱۲ گرم می باشد.
کاربرد عدد آووگادرو
همانطور که قبلا هم بیان شد، عدد آووگادرو بسیار مهم می باشد، زیرا با کمک آن می توان مقدار ماده را به تعداد ذرات آن نسبت داد. از آنجائیکه اتم ها و مولکول ها ذراتی بسیار کوچک می باشند، بنابراین جرم بسیار کمی دارند. از این رو، اندازه گیری جرم آنها با ترازو های معمولی که واحد گرم دارند کاری غیر ممکن است.
بهترین راه حل این است که جرم تعدادی از آنها را که شامل ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ تعداد است در نظر گرفت. در واقع محققین جرم این تعداد از ذره را که قابل اندازه گیری با ترازو می باشد را مبنای کار خود قرار می دهند.
مفهوم مول
مول، واحد SI برای اندازهگیری ذرات شیمیایی (مولکول، اتم، الکترون، پروتون، یون و یا هر ذره ای دیگر) می باشد. در واقع یک مول از ماده نشان دهنده تعداد ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ از همان ماده است. مول واحد جرم اتمی را به گرم تبدیل می کند که این گرم همان جرم اتمی می باشد. به این ترتیب جرم اتمی قابل اندازه گیری و محاسبه می شود. به عنوان مثال : ۲ مول هیدروژن، ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ × ۲ اتم هیدروژن دارد.
مفهوم اتم گرم
اتم گرم در واقع جرم یك مول یا ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ اتم می باشد. واحد آن بر حسب گرم بیان می شود. برای مثال اتم كربن ۱۲ گرم است. یعنی جرم یك مول از اتم های کربن كه شامل ۱۰۲۳×۶.۰۲۲۱۴۰۷۶ اتم است، برابر با ۱۲ گرم می باشد.
مفهوم مولكول گرم
جرم یك مول از مولكول های یك ماده مولكول گرم نامیده می شود. به عنوان مثال، مولکول CO۲ از دو اتم اکسیژن و یک اتم کربن تشکیل شده است. بنابراین مولکول گرم CO۲ برابر با ۴۴=۱۶+۱۶+۱۲ گرم می باشد.
مفهوم وزن مولکولی و رابطه آن با جرم مولی
همانطور که در بخش مول اشاره شد، تعداد اجزای یک مول برابر با ثابت آووگادرو می باشد. بنابراین، ثابت آووگادرو جرم مولی یک ماده را با وزن مولکولی آن ماده مرتبط میکند. در واقع می توان گفت که تعداد مولکول های موجود در یک مول از یک ترکیب مولکولی برابر با ثابت آووگادرو می باشد. جرم آن (بر حسب گرم) برابر با وزن مولکولی آن ترکیب خواهد بود. به عنوان مثال، وزن مولکولی آب برابر با ۱۸/۰۲ amu است. در نتیجه می توان گفت هر مول از مولکول آب ۱۸/۰۲ گرم می باشد.
۱۸/۰۲ g H۲O = 1mol H۲O = ۶.۰۲۲۱۴۰۷۶×۱۰۲۳ مولکول H۲O
سایر کاربرد های عدد آووگادرو
از دیگر کاربرد های ثابت آووگادرو می توان به ارتباط بین ثابت های مختلف فیزیکی اشاره کرد. به عنوان مثال داریم:
۱- رابطه بین ثابت بولتزمن (kB) و ثابت گازها (R)
R = kB × NA
۲- رابطه بین واحد جرم اتمی (u) با ثابت جرم مولی (Mu)
۱u = Mu/ NA
۳- رابطه بین ثابت فارادی (F) و بار الکترون
F = NA × e
عدد آووگادرو از کجا آمده است
مفهوم اندازه گیری ذرات میکروسکوپی که جهان اطراف شما را می سازند را می توان از طریق ثابت بنیادی – عدد آووگادرو توضیح داد. این عدد سنگ بنای شیمی مدرن و درک رفتار ماده در سطوح مولکولی و اتمی است. اصطلاح عدد آووگادرو پس از آمدئو آووگادرو، دانشمند ایتالیایی که مفهوم مول را در سال ۱۸۱۱ مطرح کرد، ابداع شد. این یک ثابت بنیادی است که نشان دهنده تعداد ذرات در یک مول از یک ماده است. یک مول از یک ماده به عنوان مقدار آن ماده حاوی تعداد ذرات آووگادرو تعریف می شود. به طور خاص، عدد آووگادرو تعداد اتمها، مولکولها، یونها یا الکترونها است. اندازه آن ۶.۰۲۲۱۴۰۸۵۷ X 10 (23) است.
عدد آووگادرو به دانشمندان اجازه می دهد تا شکاف بین دنیای میکروسکوپی اتم ها و مولکول ها را به دنیای ماکروسکوپی که ما روزانه مشاهده و تجربه می کنیم، پر کنند. در شیمی، از این عدد برای اندازه گیری دقیق تعداد مواد درگیر در یک واکنش شیمیایی خاص استفاده می شود. با دانستن تعداد ذرات موجود در یک مول از یک ماده، شیمیدانان می توانند تعداد واکنش دهنده ها و محصولات دخیل در واکنش شیمیایی را بدست آورند. از عدد آووگادرو برای تعیین واحد اندازه گیری به نام مول نیز استفاده می شود. مول واحد اندازه گیری است که به شیمیدانان امکان اندازه گیری و مقایسه مقادیر مواد را در مقیاس ماکروسکوپی می دهد. یک مول از یک ماده، بدون توجه به وزن مولکولی یا فرمول شیمیایی، حاوی تعداد ذرات آووگادرو است.
این به شیمیدانان اجازه می دهد تا دنیای میکروسکوپی اتم ها و مولکول ها را به دنیای ماکروسکوپی گرم و مول مرتبط کنند. برای محاسبه جرم مولی یک ماده استفاده می شود که جرم یک مول ماده است. دانستن جرم مولی به شیمیدانان این امکان را می دهد که مقدار ماده مورد نیاز برای یک واکنش شیمیایی و همچنین مقدار محصولی که تولید می شود را تعیین کنند.



















