مدل فضا پرکن ترکیبات شیمیایی چیست؟ – ساختار و شکل هندسی مولکول ها

به نمایش سه بعدی مولکول ها در علم شیمی، مدل فضا پرکن ترکیبات شیمیایی می گویند. در این روش، هر کدام از اتم های تشکیل دهنده ترکیب شیمیایی به صورت یک کره نمایش داده می شود. همچنین این روش، شکل، اندازه اتم و پیوند بین اتم های واقعی تری نسبت به روش مدل گلوله و میله دارد. اما عیبی که در مدل فضا پرکن ترکیبات شیمیایی وجود دارد، عدم نمایش تعداد و وضعیت قرار گرفتن پیوندهاست. مدل فضا پرکن ترکیبات شیمیایی که در این مقاله نشریه جهان شیمی فیزیک مورد بحث قرار می گیرد، توسط انجمن بین المللی شیمی محض و کاربردی (آیوپاک) به تایید رسیده است.
شکل مولکول چیست؟
هر مولکول دارای شکل مشخص و معینی است که با توجه به نوع شکل خود دارای خواص فیزیکی و شیمیایی مخصوص است. مولکول ها وقتی دارای شکل پیش بینی شده ای هستند که دارای یک اتم مرکزی باشند. شکل هر مولکول و طرز قرار گرفتن اتم ها در آن، با توجه به نظریه دافعه زوج الکترون لایه ظرفیت (VSEPR) مشخص می شود. در این نظریه، با بالاترین حد دافعه الکترون ها، بیشترین فاصله بین آن ها ایجاد می شود. به عبارتی ساختار شیمیایی یک مولکول، ساختار الکترونی، ساختار کریستالی و همچنین هندسه مولکولی یک مولکول را شامل می شود.
هندسه مولکولی به چگونگی آرایش فضایی اتم ها در یک مولکول و همچنین چگونگی قرار گرفتن پیوندهای شیمیایی اتم ها را می گویند. شکل یک مولکول با توجه به تعداد قلمروهای الکترونی که در اطراف اتم مرکزی وجود دارد، تعیین می شود. شکل و هندسه مولکول ها می تواند به صورت ساده و یا پیچیده باشد.
این که در یک مولکول، چگونه الکترون ها، اوربیتال های مولکولی را پر می کنند، ساختار الکترونی آن را نشان می دهد.
هندسه مولکولی
با تعیین ساختار سه بعدی و نوع آرایش مولکول ها که به نام هندسه مولکولی نام دارد، می توان خواصی چون قطبیت، حالت مواد، مغناطیسی، رنگ، واکنش پذیری و حتی فعالیت های بیولوژیکی آن را مشخص کرد. در تعیین هندسه مولکولی، ابتدا ساختار لوئیس را رسم می کنیم که با آن می توان جفت الکترون های پیوندی و ناپیوندی را تعیین کرد. سپس با استفاده از نظریه VSEPR شکل هندسی مولکول ها تعیین می شود.
با توجه به هسته و الکترون هایی اطراف آن، آرایش اتم ها به گونه ای نمایش داده می شود که دافعه در آن ها به مینیمم مقدار خود و جاذبه به حداکثر مقدار خود برسد. به عبارتی شکل مولکول باید طوری باشد که سیستم در کمترین میزان انرژی قرار گیرد.
تعیین شکل مولکول ها با استفاده از نظریه VSEPR
شکل هندسی یک مولکول با استفاده از نظریه دافعه زوج الکترون لایه ظرفیت تعیین می شود. بدین صورت که بر طبق این نظریه، آرایش فضایی به دور هر اتم به صورتی خواهد بود که دافعه بین جفت الکترون ها حداکثری بوده و به کمترین حد خود برسد. در ترسیم شکل و ساختار یک مولکول، ابتدا آرایش الکترونی آن را به صورت ABnEm می نویسیم. A اتم مرکزی است، یعنی اتمی است که آرایش فضایی آن باید تعیین شود. اما B اتم و یا گروه هایی است که به اتم مرکزی متصل هستند. n تعداد اتم های متصل را نشان داده و E جفت الکترون های غیرپیوندی است که روی A وجود دارد. m نشان دهنده تعداد جفت الکترون های غیرپیوندی است.
با توجه به فرمول مولکولی که گفته شد، تعداد قلمرو الکترونی حاصل جمع تعداد اتم یا گروه های متصل با تعداد جفت الکترون ها (m+n) خواهد بود. با تعیین قلمروهای الکترونی به راحتی می توان شکل یک مولکول را تعیین کرد.
تعیین شکل مولکول ها با استفاده از قلمرو الکترونی
ساختار خطی
وقتی تعداد دو قلمرو الکترونی برای یک مولکول وجود داشته باشد، مانند CO۲، دو گروه طوری قرار می گیرند که بیشترین فاصله را از هم داشته باشند. بهترین شکل حالتی است که دو گروه با زاویه ۱۸۰ درجه ای نسبت به هم قرار گیرند. با توجه به این قرارگیری، شکل مولکول خطی خواهد بود. فرمول کلی این مولکول ها به صورت AB۲ است و BeF۲ مثالی از این مورد است.

ساختار مثلثی
اما در صورتی که سه قلمرو الکترونی وجود داشته و شکل کلی مولکول به صورت AB۳ باشد، در صورتی گروه های متصل حداکثر فاصله را از هم خواهند داشت که شکل مولکول به صورت سه ضلعی مسطح باشد. زوایای پیوندی در این هنگام ۱۲۰ درجه است. BF۳ و AlCl۳ مثال هایی از مولکول ها هستند.
اما اگر تنها دو قلمرو از سه قلمروی الکترونی در پیوند شرکت کنند، یعنی فرمول مولکول به صورت AB۲E باشد، شکل مولکول به صورت خمیده خواهد بود. در این صورت زوایای پیوندی کمتر از ۱۲۰ درجه می شوند. SO۲ و NO۲– مثالی از این نوع مولکول هاست. در این مثال زاویه پیوندی به ترتیب ۱۱۹ و ۱۱۵ درجه است.
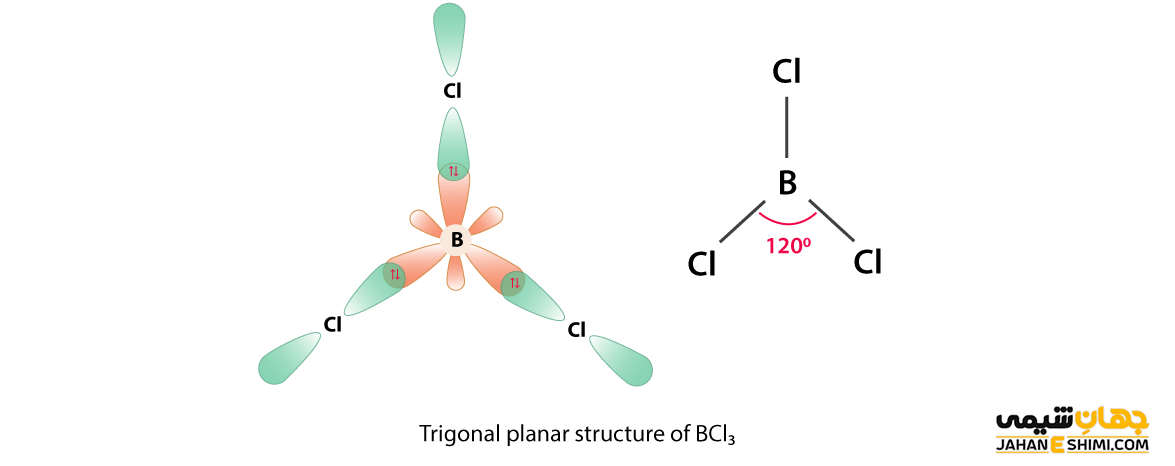
ساختار چهاروجهی
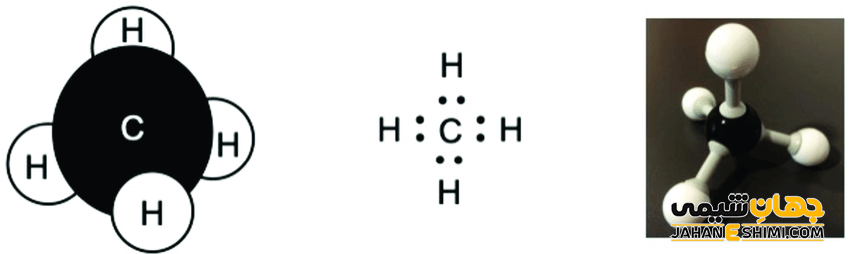
مولکولی که چهار قلمرو الکترونی داشته باشد و فرمول آن به صورت AB۴ باشد، شکل آن به صورت چهاروجهی خواهد بود. زاویه پیوندی در این مولکول ها برابر ۱۰۹ درجه و ۲۸ دقیقه و یا همان ۱۰۹,۵ درجه است. متان (CH۴) و SiH۴ مثال هایی از این نوع مولکول ها هستند.
اگر فرمول مولکولی به صورت AB۳E باشد، یعنی یک جفت الکترون به جای یکی از گروه های اتمی آن قرار گیرد، شکل مولکول به صورت هرمی مثلثی خواهد بود. زاویه پیوندی در این مولکول ها کمتر از ۱۰۹,۵ درجه است. NH۳ و SO۳۲- نمونه هایی از این نوع مولکول هستند که زاویه پیوندی در آن ها به ترتیب، ۱۰۷ و ۱۰۶ درجه است.
شکل مولکول هایی با فرمول AB۲E۲، خمیده و زاویه پیوندی آن ها کمتر از ۱۰۹,۵ درجه است. در این نوع مولکول ها که آب نمونه ای از آن است، به جای دو گروه اتمی، دو جفت الکترون ناپیوندی قرار می گیرد. زاویه پیوندی در مولکول آب، ۱۰۴,۵ درجه است. NH۲– ننیز مثالی دیگر است که زاویه پیوندی برابر با ۱۰۵ درجه دارد.
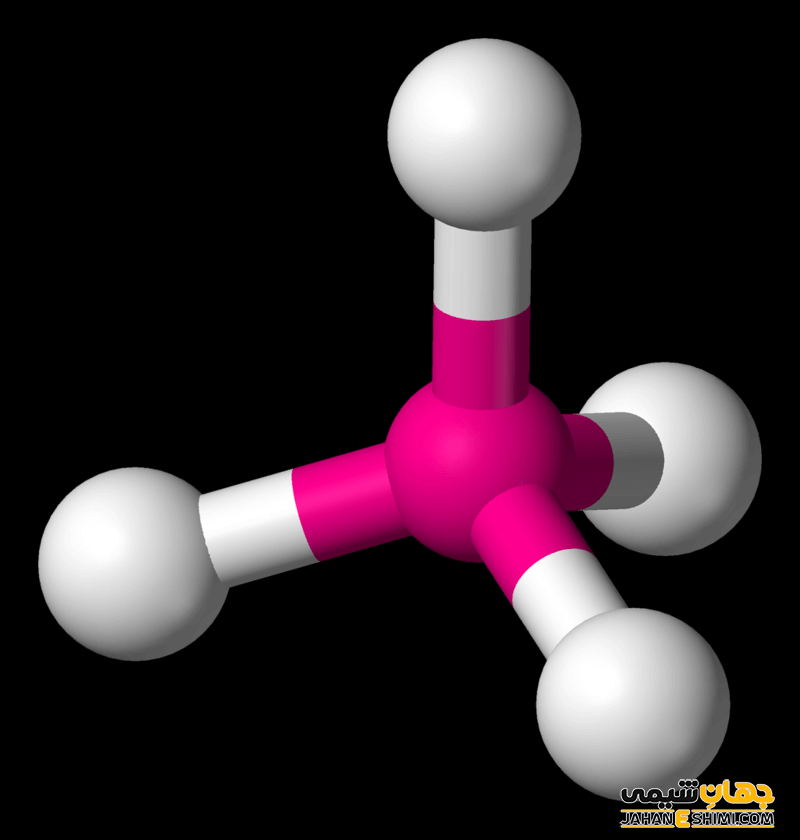
شکل مولکول ها با بیش از یک اتم مرکزی
مولکول ها می توانند به جای یک اتم مرکزی، چند اتم مرکزی داشته باشند. به عنوان مثال، ترکیبات هیدروکربنی از زنجیرهای طویل الکترونی تشکیل شده اند. برای تعیین شکل مولکولی، هر قسمت آن را به طور جداگانه بررسی می کنیم. به عنوان مثال، در بوتان، اولین اتم کربن از سمت چپ، به عنوان یک اتم مرکزی در نظر گرفته می شود. این اتم به سه اتم هیدروژن و یک اتم کربن متصل است و در نتیجه چهار قلمرو الکترونی دارد. شکل این مولکول، چهاروجهی است. کربن دوم از بوتان نیز با دو پیوند با دو کربن و دو پیوند با دو هیدروژن، یک چهاروجهی را تشکیل می دهد. در بوتان که هیچ جفت الکترون ناپیوندی دیده نمی شود، چهار شکل چهار وجهی وجود دارد.
مدل نمایش ترکیبات شیمیایی
بعد از رسم ساختار مولکول ها، در فضا می توان این ساختارها را با استفاده از مدل هایی نمایش داد. مولکول های شیمیایی را می توان با استفاده از دو مدل میله و گلوله و مدل فضا پرکن ترکیبات شیمیایی نشان داد.
مدل گلوله و میله ترکیبات شیمیایی
یکی از راه های نشان دادن شکل سه بعدی مولکول ها، مدل گلوله و میله است. در این مدل، اتم ها با استفاده از گلوله های با رنگ های مختلف نشان داده شده و پیوند بین اتم ها نیز با استفاده از میله نمایش داده می شود. در این مدل، تعداد پیوندها و همچنین طریقه قرارگیری آن ها در فضا به خوبی نشان داده می شود. مدل گلوله و میله از لحاظ آموزشی بسیار مهم است. از معایب این روش، متفاوت بودن شکل واقعی مولکول ها از شکلی است که با این روش نشان داده می شود. به عنوان مثال، اندازه پیوندها در این روش نسبت به اندازه اتم ها بسیار بزرگ تر است.
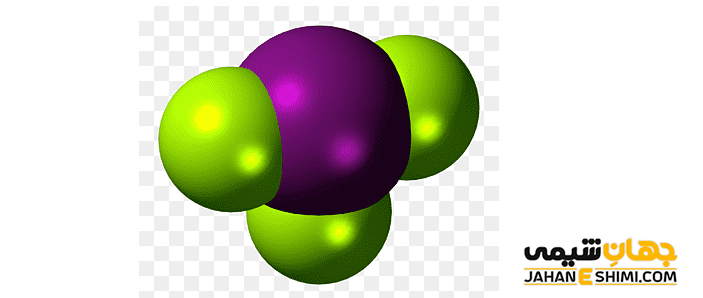
مدل فضا پرکن ترکیبات شیمیایی
در مدلی که به نام فضا پرکن برای نشان دادن ترکیبات شیمیایی به کار برده می شود، شکل مولکول ها به صورت سه بعدی نشان داده می شود و اتم ها در این مدل به صورت کره هایی نمایش داده می شوند. در مقایسه با مدل گلوله و میله، مدل فضا پرکن، از اندازه واقعی تری برای اتم ها و پیوندها برخوردار است. همان طور که در بالا نیز اشاره شد، از معایب این روش این است که نمی توان تعداد پیوندها و وچگونگی قرارگیری آن ها را به خوبی نشان داد.
نرم افزارهای نمایش ترکیبات شیمیایی
یکی از نرم افزارهای بسیار کاربردی و مهمی که برای نمایش مولکول های شیمیایی به کار برده می شود، Chem Draw Ultrta است. این نرم افزار که نامی بسیار آشنا برای شیمیست ها است، برای طراحی و فرمول نویسی ترکیبات شیمیایی به کار می رود. در نوشتن مقالات، پاین نامه ها و …، این نرم افزار که سازگار با Word است به کار برده می شود. همچنین این نرم افزار از مجموعه نرم افزارهای Chem Office است.
نرم افزار Chem Draw Ultrta دارای قابلیت های زیادی است. از جمله این که می تواند انواع ساختارهای شیمیایی را طراحی کرده و با کپی کردن به محیط های دیگر نرم افزاری منتقل کند. شکل و ساختار مولکول از روی نام آن ها به وسیله این نرم افزار کشیده شده و می تواند به روش آیوپاک آن ها را نام گذاری کند. همچنین توانایی آن در پیش بینی شیفت های مربوط به پروتون NMR و کربن NMR با دقت بالایی انجام می شود. اگر ساختار گسترده ترکیبی را به این نرم افزار دهید، می تواند نام آن را نشان دهد.
روش های معمول نمایش ساختار در شیمی
با استفاده از روش های زیادی می توان ساختار شیمیایی مولکول ها را تعیین کرد. از جمله روش هایی که برای این منظور به کار برده می شود، پراش X-ray، پروتون NMR، کربن-۱۳ NMR، طیف سنجی جرمی و طیف سنجی مادون قرمز (IR) هستند.



















