متیل متانوات و پنتیل متانوات چیست؟ – استر و سنتز آن
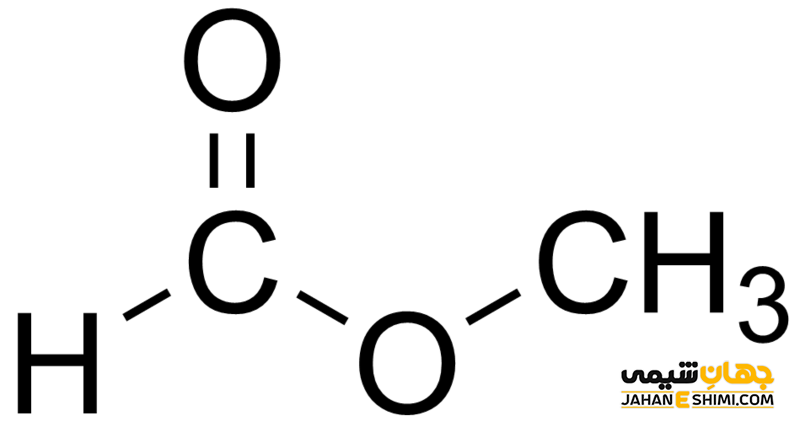
متیل متانوات و پنتیل متانوات ترکیباتی در دسته ی استرها هستند که شکل کلی آن ها به صورت RCOOR است. استرها مشتقاتی از اسیدهای کربوکسیلیک هستند که به جای هیدروژن گروه عاملی کربوکسیلیک، گروه کربنی قرار می گیرد. گروه کربنی می تواند آلکیل و یا گروه دارای حلقه بنزنی باشد. استرها در ترکیب میوه ها و گل ها وجود داشته و باعث عطر و بوی خوب در آن ها می شوند.
از مهمترین بنیان های آلکانواتی که درنام گذاری استرها قرار می گیرند، متانوات و اتانوات هستند. این مقاله نشریه جهان شیمی فیزیک ما را با استرها، خواص آن ها و همچنین برخی از مثال های آن مانند متیل متانوات و پنتیل متانوات آشنا می کند.
استر چیست؟
استر مشتقی از اسید کربوکسیلیک است که فرمول کلی RCOOH دارد و اتیل اتانوات از ساده ترین استرهاست. در این استر به جای اتم هیدروژن گروه عاملی COOH، گروه اتیل قرار گرفته است. یکی از انواع استرها که در حیات جانداران اهمیت دارد، گلیسیریدها هستند که به عنوان استر اسیدهای چرب گلیسرول هستند. استرهایی که جرم مولکولی کمی دارند به دلیل معطر بودن در ساخت عطرها مورد استفاده قرار می گیرند. در ساختار مولکول DNA، فسفواسترها وجود دارند.
همچنین در ترکیب پلاستیک ها، رزین ها و مواد براق کننده استرها وجود دارند. گروه عاملی کربونیل در استرها با استفاده از اسپکتروسکوپی مادون قرمز، پیکی را در محدوده ۱۷۳۰ تا ۱۷۵۰ بر سانتی متر نشان می دهند. وجود گروه مزدوج در نزدیکی گروه کربونیل، محدوده طیف IR را به سمت فرکانس های پایین تر سوق می دهد.
ساختار استرها
در استرها بین پیوندهای C-C-O و همچنین پیوندهای O-C-O، زاویه ی ۱۲۰ درجه ای برقرار است. استرها به عنوان گروه های عاملی که دارای انعطاف هستند و غیرقطبی هستند، نقطه ذوب کمی داشته و مولکول هایی با مقاومت کم هستند. این مولکول ها در مقایسه با آمیدهای متناظر با خود، دارای فراریت بالایی هستند. قدرت اسیدی هیدروژن های آلفای استرها، بسیار کم بوده و فقط وقتی که در مجاورت با بازهای بسیار قوی قرار می گیرند، می توانند از خود خاصیت اسیدی نشان دهند.
ویژگی های فیزیکی استرها
استرهایی با تعداد کربن مشابه، دارای نقطه جوشی نزدیک به نقطه جوش آلدهیدها و کتون ها هستند. نیروهای بین مولکولی در استرها، از نوع دوقطبی – دوقطبی و واندروالسی است، چون این ترکیبات، قطبی هستند. نقطه جوش استرها در مقایسه با ترکیبات اسیدی مشابه در تعداد اتم کربن، کمتر است، چون این مواد بر خلاف اسیدها نمی توانند پیوند هیدروژنی برقرار کنند.
با این که استرهای نمی توانند در تشکیل پیوند هیدروژنی با مولکول های خود شرکت کنند، ولی قابلیت انحلال خوبی در آب دارند. زیرا توانایی تشکیل پیوند هیدروژنی با مولکول های آب را دارند. استرهایی با تعداد کربن کمتر، حلالیت بالاتری دارند. پیوند هیدروژنی بین اتم هیدروژن مولکول آب و یکی از اکسیژن های عامل استری برقرار می شود. پیوند هیدروژنی در کنار پیوندهای دوقطبی- دوقطبی و واندروالسی باعث حلالیت خوب آن در آب می شود. اما با بزرگ شدن بخش هیدروکربنی استرها و وارد شدن فشار بیم مولکول های آب، پیوندهای هیدروژنی کم شده و به دلیل مهیا نشدن انرژی لازم تشکیل پیوند بین استرها با مولکول های آب، حلالیت آن کاهش پیدا می کند.
نام گذاری استرها
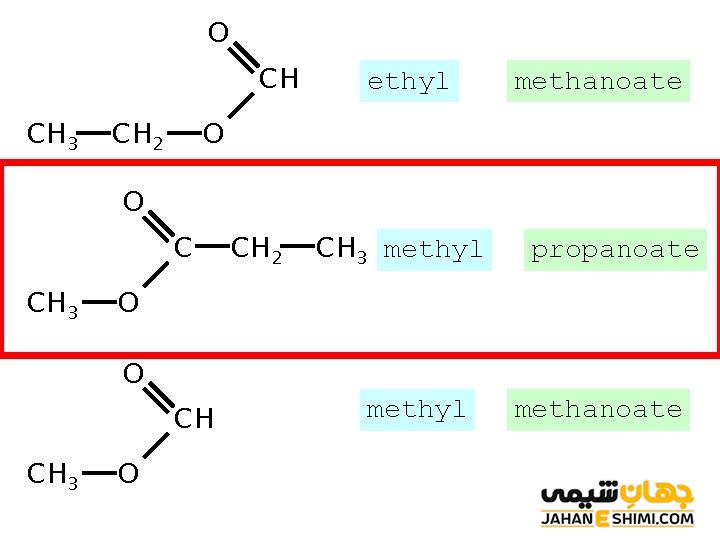
در علم شیمی، استر به ترکیب متشکل از یک اسید و یک الکل گفته می شود. اگر یک کربوکسیلیک اسید به یک الکل واکنش دهد، استر تولید می شود. به عنوان نمونه وقتی اسید استیک با الکل واکنش می دهد، اسید استیک و آب تشکیل می شود. با توجه به طرز تهیه استرها، آیوپاک برای نام گذاری آن ها از آن بهره برده است. به طوری که در نام گذاری استرها، ابتدا نام آلکیل گروه الکل سازنده که همان آلکیلی است که به اتم اکسیژن با پیوند ساده متصل شده است را می نویسند، سپس نام آلکان اسید سازنده استر را می نویسند. این گروه آلکانی نیز به اکسیژن با پیوند دوگانه متصل شده است. نام این آلکان را به صورت آلکانوات می نویسند.

اما در روش قدیمی برای نام گذاری استرها، از همان روش آیوپاک استفاده می کنند. ولی به جای آلکانوات از نام اسید قدیمی که استر از آن ساخته شده است، استفاده می شود.
به عنوان مثال در نام گذاری استر C۲H۵ COO C۲H۵، آلکیل متصل به اتم تنهای اکسیژن، اتیل و آلکانوات متصل به اتم اکسیژن کربونیل، اتانوات است. نام استر به صورت اتیل اتانوات خواهد بود. در نام گذاری قدیمی، نام این استر به صورت اتیل استات خواهد بود.
متیل متانوات و پنتیل متانوات
متیل متانوات و پنتیل متانوات مثال هایی از استرها هستند که به جای گروه آلکیل آن متیل و پنتیل و به جای آلکانوات آن، متیل قرار گرفته است. نام قدیمی متیل متانوات، متیل فرمات است که متیل استر اسید فرمیک است. در واقع ساده ترین استر، همین متیل فرمات است که مایعی بی رنگ با بوی بسیار معطر است. این ماده دارای کشش سطحی کم و فشار بخار بالاست.
از واکنش بین متانول با اسید فرمیک، متیل فرمات تشکیل شده است. اما در صنعت، این ترکیب را از واکنش بین متانول و مونوکسید کربن در مجاورت باز قوی مانند سدیم متوکسید به دست می آورند. به دلیل حساس بودن کاتالیزور این واکنش به آب، از مونوکسید کربن خشک به کار گرفته می شود.
کاربرد متیل متانوات یا متیل فرمات
در ساخت بسیاری از مواد مهم از مواد اولیه ای چون فرم آمید، دی متیل فرمامید و اسید فرمیک استفاده می کنند که این مواد از متیل فرمات به دست می آید. چون متیل متانوات دارای فشار بخار زیادی است، می تواند در خشک کردن در مدت زمان کوتاه استفاده شود. در تولید فوم اورتان ها و همچنین به جای کلروفلوئوروکربن ها از متیل متانوات استفاده می شود. قبل از این که سردسازهای امروزی ساخته شوند، از متیل فرمات برای سردسازی استفاده می شد که به جای دی اکسید گوگرد در یخچال ها به کار برده می شد. اما به دلیل سمیت زیاد، امروزه از این ماده استفاده نمی کنند.
خطرات و مضرات کاربرد متیل متانوات
بخارات متیل متانوات، اشتعال پذیر بوده و حتی استنشاق بخار آن می تواند ایجاد اختلالاتی چون سرگیجه، خواب آلودگی، سوزش چشم و حتی دستگاه تنفسی را سبب شود. اگر به مدت زمان طولانی در مجاورت با متیل متانوات قرار گیرید، پوستتان خشک شده و دچار ترک خوردگی می شود. در صورت تماس با پوست باید با آب فراوان شسته شود. همچنین لباس ها و کفش هایی که آلوده به این ماده هستند را دور کرده و قبل از استفاده دوباره، شست و شو دهید. بیشترین قسمت بدن که تحت تاثیر تماس با این ماده قرار می گیرد، پوست، چشم و سیستم تنفسی انسان هاست. اگر متیل فرمات توسط افراد خورده شود، باعث تهوع و استفراغ شده و دستگاه گوارشی را تحت تاثر قرارمی دهد. در صورت ادامه، سیستم تنفسی افراد می تواند دچار اختلال و نقص شود.
ایمنی کار با متیل متانوات
اولین این که متیل متانوات را به دور از حرارت، شعله، جرقه و حتی سطح های داغ نگهداری کنید. از استشمام بخارات این ماده و ورود گرد و غبار آن به سیستم تنفسی جلوگیری کنید. اگر این ماده با پوست و چشم شما تماس پیدا کرد، فورا با آب فراوان بشویید. در صورت خوردن متیل فرمات، دهان فرد با آب فراوان شسته شود. اگر آتش سوزی ناشی از متیل متانوات ایجاد شد، برای خاموش کردن آن از آب، کف هایی که در برابر الکل مقاوم هستند، دی اکسید کربن و یا مواد شیمیایی خشک استفاده کنید.
استری شدن
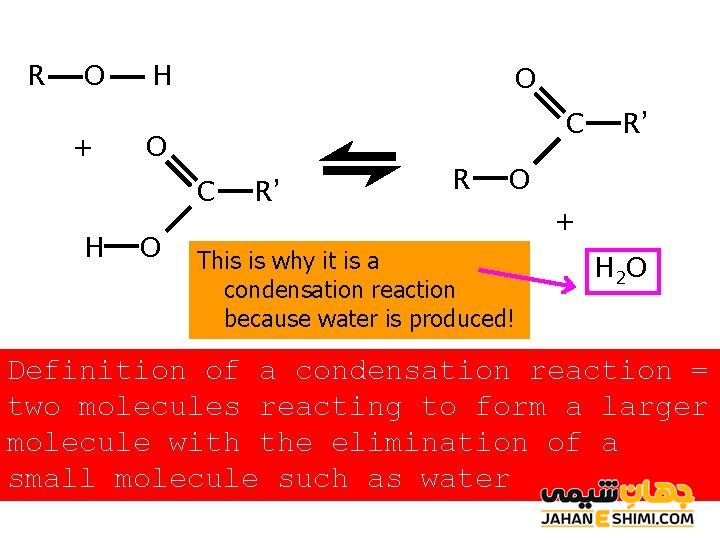
همان طور که در بالا نیز اشاره شد، واکنش بین الکل با یک اسید کربوکسیلیک را استری شدن می گویند. در این واکنش، از اسیدهای معدنی به عنوان کاتالیزگر استفاده شده و همراه با استر، آب نیز تولید می شود. این روش را به نام روش فیشر می نامند که روشی مستقیم در تولید این ترکیبات است. از روش های دیگر تولید استرها، واکنش بین الکل ها، آلکن ها با کلرواسیدهاست. استرها را از تبدیل اسیدهای کربوکسیلی توسط نمک های دی آزونیوم نیز می توان به دست آورد.
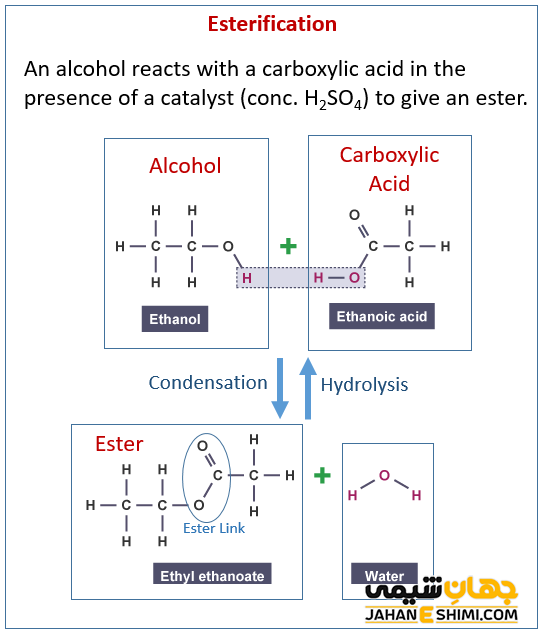
واکنش فیشر که معمول ترین روش تهیه ی استرهاست، با واکنش های اسید و باز متفاوت است. یکی از تفاوت های مهم این دو واکنش، یک طرفه بودن واکنش اسید و باز و دو طرفه و کند بودن واکنش فیشر است. همچنین در واکنش استری شدن از کاتالیزور اسیدی مانند اسید سولفوریک استفاده می شود. چون بدون استفاده از یک کاتالیزور، حتی اگر دما بالا باشد، واکنش استری شدن هفته ها طول می کشد تا به حالت تعادل برسد. مولکول آبی که در این واکنش تولید می شود، هیدروژن خود را از الکل و هیروکسی خود را از اسید می گیرد. این موضوع با استفاده از اکسیژن نشاندار تایید شده است.
هیدرولیز استرها
هیدرولیز و یا آبکافت به برعکس واکنش استری شدن می گویند. محیط انجام این واکنش می تواند اسیدی و یا بازی باشد. اگر محیط اسیدی باشد، از هیدرولیز استرها، اسید و الکل تشکیل می شود. در صورتی که محیط قلیایی باشد، محصول هیدرولیز استرها، نمکی از اسید کربوکسیلیک و الکل خواهد بود. صابونی شدن نام این واکنش است. صابون همان نمک های فلزی اسیدهای کربوکسیلیک است.



















