انرژی نخستین یونش چیست و چه عواملی بر آن اثر می گذارد؟

انرژی نخستین یونش انرژی مورد نیاز برای حذف الکترون با بالاترین انرژی از یک اتم است. انرژی مورد نیاز برای حذف یک الکترون از یک اتم با رفتن از فلز به غیر فلز افزایش می یابد، زیرا بار هسته در یک جهت افزایش می یابد. بنابراین الکترون های ظرفیتی توسط نیروهای جاذبه برای غیرفلزها نسبت به فلزات بسیار محکم تر نگه داشته می شوند. در نتیجه، برای حذف الکترون از یک نافلز به انرژی بیشتری نسبت به یک فلز نیاز دارید.
انرژی نخستین یونش با پایین آمدن از یک گروه کاهش می یابد. با توجه به شعاع اتمی، با پایین آمدن از یک گروه جدول تناوبی، پوسته های الکترونی بیشتر می شوند. بنابراین الکترون های ظرفیت تحت تأثیر محافظت کمتری قرار می گیرند و بار موثر هسته کاهش می یابد. از این رو، با پایین آمدن از یک گروه در جدول تناوبی، بار هسته ثابت می ماند اما الکترون های ظرفیت کمتر تحت تأثیر قدرت هسته قرار می گیرند.
در نتیجه حذف یک الکترون از یکی از عناصر پایینی یک گروه جدول تناوبی نسبت به عناصر بالاتر آسان تر خواهد بود. برای کسب اطلاعات بیشتر در مورد انرژی نخستین یونش، لطفا تا انتها با ما در این مقاله از نشریه جهان شیمی فیزیک همراه باشید.
انرژی یونیزاسیون چیست
انرژی یونیزاسیون که پتانسیل یونیزاسیون نیز نامیده می شود، خاصیتی است که همه عناصر جدول تناوبی از آن برخوردار هستند. انرژی یونیزاسیون مقدار انرژی مورد نیاز برای حذف یک الکترون از یک اتم خنثی است که در نتیجه یک یون را تشکیل می دهد. این انرژی معمولا بر حسب kJ/mol اندازه گیری می شود و اندازه گیری بر اساس یک اتم جدا شده در فاز گازی آن است. انرژی یونیزاسیون را می توان با معادله زیر به خوبی نشان داد:
X + + e → اولین انرژی یونیزاسیون + X
در این معادله، X اتم خنثی، X + یونی از اتم X با یک بار مثبت است و e – الکترونی با یک بار منفی است. در این معادله، اولین انرژی یونیزاسیون، به انرژی یونیزاسیون مورد نیاز برای حذف اولین الکترون از یک اتم خنثی اشاره دارد که یونی با یک بار مثبت ایجاد می کند. انرژی یونیزاسیون دوم مقدار انرژی مورد نیاز برای حذف الکترون دوم از یون دارای یک بار مثبت است که در نهایت یونی با دو بار مثبت ایجاد می کند.

یون چیست
یک یون یک اتم با بار مثبت یا منفی است که با داشتن تعداد الکترون نابرابر با پروتون هایش، بار منفی یا مثبت دارد. به عنوان مثال، یون سدیم که به صورت Na+ نیز نوشته می شود، دارای ۱۱ پروتون و ۱۰ الکترون است. یون سدیم یک پروتون بیشتر از الکترون ها وجود دارد که باعث می شود یون دارای بار مثبت شود.
روش محاسبه انرژی یونش
شیمیدانان معمولا انرژی نخستین یونش را با معادلات شیمیایی بسیار ساده نشان می دهند. معادلات شامل عبارت هایی برای عناصر با بار خنثی قبل از یونیزه شدن و عبارت هایی برای یون ها و الکترون های با بار مثبت و منفی است که در طول فرآیند یونیزاسیون ایجاد می شوند. عنصر با بار خنثی و اصطلاحات یون با بار مثبت همیشه با نماد های حالت گازی نوشته می شوند، زیرا انرژی یونیزاسیون برای گازها به جای مایعات یا جامدات اندازه گیری می شود. انرژی های یونیزاسیون اول همیشه اعداد مثبت هستند، زیرا باید انرژی صرف کنیم تا الکترون های لایه بیرونی را از اتم های با بار خنثی حذف کنیم. انرژی نخستین یونش را می توان با استفاده از رابطه زیر محاسبه کرد:
E = hcRH(۱/n۲)
در این معادله:
- E انرژی یونیزاسیون است (یا مقدار انرژی لازم برای حذف الکترون)
- h ثابت پلانک است = ۶.۶۲۶ * ۱۰-۳۴ Js (ژول در ثانیه)
- c سرعت نور = ۳.۰۰ * ۱۰۸ m/s (متر بر ثانیه) است.
- RH ثابت ریدبرگ است = ۱.۰۹۷ * ۱۰۷ m-۱
- n عدد کوانتومی اصلی (یا سطح انرژی) الکترون است
پس از جایگذاری مقادیر ثابت در معادله بالا، می توان به معادله زیر دست یافت.
E = (2.18 * 10-۱۸ J)(1/n۲)
انرژی یونش عناصر
برای نشان دادن روند انرژی یونیزاسیون عناصر در جدول تناوبی، فرض می کنیم که ما همیشه به اولین انرژی یونیزاسیون عناصر اشاره می کنیم. به طور کلی، انرژی نخستین یونش از سمت گوشه سمت راست بالای جدول تناوبی افزایش می یابد و هلیوم دارای بالاترین انرژی یونیزاسیون است. قبل از اینکه روند را به دورهها یا گروه ها تقسیم کنیم، اجازه دهید در مورد یک عامل اصلی به نام قانون اکتد یا هشت تایی در ایجاد این روند صحبت کنیم.
قانون اکتد یا هشت تایی
طبق قانون اکتد، اتم ها تلاش می کنند تا مجموعه ای کامل از ۸ الکترون ظرفیتی داشته باشند. دلیل این امر این است که پیکربندی هشت تایی الکترون بیشترین ثبات را برای اتم فراهم می کند. گازهای نجیب گروه ۱۸ دارای یک هشت الکترون هستند که باعث می شود آنها از نظر شیمیایی بی اثر و غیر واکنشی باشند.
اتم های گاز نجیب با عناصر دیگر واکنش نشان نمی دهند، زیرا به دلیل وجود هشت الکترونی که دارند، از قبل بسیار پایدار هستند. از آنجایی که اتم ها تلاش می کنند تا هشت الکترون داشته باشند، انرژی یونیزاسیون هر اتم بر اساس تعداد الکترون های آنها متفاوت است.
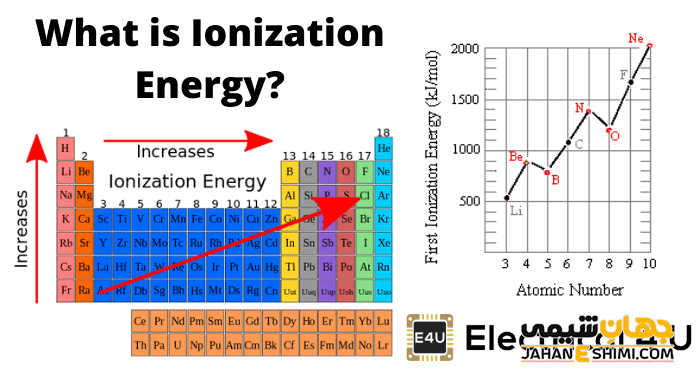
روند دوره انرژی نخستین یونش در جدول تناوبی
در طول یک دوره در جدول تناوبی، انرژی های یونیزاسیون افزایش می یابد. همانطور که قبلا ذکر شد، عناصر تلاش می کنند تا الکترون ظرفیت خود را تکمیل کنند. همانطور که عناصر به طور متوالی الکترون های بیشتری در یک دوره دارند، اتم ها به مرکز خود نزدیک تر و نزدیک تر می شوند. بنابراین، حذف یک الکترون سخت تر و سخت تر می شود و انرژی نخستین یونش افزایش می یابد، زیرا اتم ها به قانون اکتد نزدیک می شوند.
یک عنصر از گروه اول جدول تناوبی که دارای یک الکترون ظرفیت است، به راحتی الکترون خود را از دست می دهد تا یک پوسته هشت الکترونی داشته باشد. بنابراین، عناصر گروه اول انرژی یونیزاسیون بسیار کمی دارند. برای حذف یک الکترون انرژی بسیار کمی نیاز است، زیرا اتم بدون آن می تواند پایدارتر باشد.
در طرف مقابل، عناصر گروه ۱۷ دارای انرژی یونیزاسیون بسیار بالایی هستند. این عناصر دارای ۷ الکترون در ظرفیت خود هستند. هالوژن ها می خواهند یک الکترون بیشتر به دست آورند تا پایدار شوند. از دست دادن یک الکترون آنها را از هدف خود دورتر می کند؛ بنابراین، انرژی بسیار بیشتری برای حذف یک الکترون لازم است.
روند گروهی انرژی نخستین یونش در جدول تناوبی
در یک گروه از جدول تناوبی انرژی یونیزاسیون به طرف پایین کاهش می یابد. وقتی از یک گروه پایین می روید، الکترون ها در سطوح انرژی متوالی بالاتری قرار گرفته و دورتر از جاذبه هسته قرار می گیرند. علاوه بر این، در یک گروه، الکترون های بیشتری بین الکترون های ظرفیت بیرونی و هسته وجود دارد. این الکترون های میانی اثر جاذبه هسته بر الکترون های بیرونی را کاهش می دهند؛ بنابراین، حذف یک الکترون از پایین ترین عنصر در یک گروه آسان تر خواهد بود.
انرژی یونیزاسیون به طور کلی از چپ به راست در طول یک دوره عنصر (ردیف) در جدول تناوبی افزایش می یابد. شعاع اتمی به طور کلی در یک دوره عنصر کاهش می یابد؛ بنابراین جاذبه مؤثر بیشتری بین الکترون های با بار منفی و هسته با بار مثبت وجود دارد. در واقع انرژی یونیزاسیون برای فلز قلیایی در سمت چپ جدول در حداقل میزان خود و برای گاز نجیب در سمت راست انتهایی یک دوره از عناصر حداکثر است. گازهای نجیب دارای یک پوسته ظرفیت پر شده هستند؛ بنابراین در برابر حذف الکترون مقاومت بیشتری از خود نشان می دهند.
انرژی های یونیزاسیون اول، دوم و بعدی
انرژی مورد نیاز برای حذف بیرونی ترین الکترون ظرفیت از یک اتم خنثی، انرژی نخستین یونش است. انرژی یونیزاسیون دوم، انرژی مورد نیاز برای حذف الکترون بعدی و غیره است. انرژی یونیزاسیون دوم همیشه بالاتر از انرژی نخستین یونش است. برای مثال یک اتم فلز قلیایی را در نظر بگیرید، برای حذف اولین الکترون انرژی کمی نیاز است، زیرا از دست دادن آن به اتم یک پوسته الکترونی پایدار می دهد. حذف الکترون دوم شامل یک پوسته الکترونی جدید است که نزدیک تر و محکم تر به هسته اتم متصل است.
استثنائات برای روند انرژی یونیزاسیون
اگر به نمودار انرژی های نخستین یونش نگاه کنید، دو استثنا در این روند به آسانی مشاهده خواهید کرد. انرژی نخستین یونش عنصر بور کمتر از بریلیم و اولین انرژی یونیزاسیون اکسیژن کمتر از نیتروژن است. دلیل این اختلاف، به دلیل پیکربندی الکترونی این عناصر و قانون هوند است.
برای عنصر بریلیم، اولین الکترون یونیزاسیون از اوربیتال ۲ s می آید، اگرچه یونیزاسیون عنصر بور شامل یک الکترون ۲ p است. هم برای نیتروژن و هم برای اکسیژن، الکترون از اوربیتال ۲ p می آید، در حالی که مجموعه ای از الکترون های جفت شده در یکی از اوربیتال های اکسیژن ۲ p وجود دارد.

انرژی یونیزاسیون دوم چیست
انرژی یونیزاسیون دوم را می توان به عنوان مقدار انرژی مورد نیاز برای حذف بیرونی ترین الکترون از یک اتم گازی با بار مثبت تعریف کرد. حذف یک الکترون از یک اتم با بار خنثی منجر به بار مثبت می شود، زیرا الکترون های کافی برای خنثی کردن بار مثبت هسته وجود ندارد. حذف یک الکترون دیگر از این اتم با بار مثبت به انرژی بسیار بالایی نیاز دارد. این مقدار انرژی را انرژی یونیزاسیون دوم می نامند.
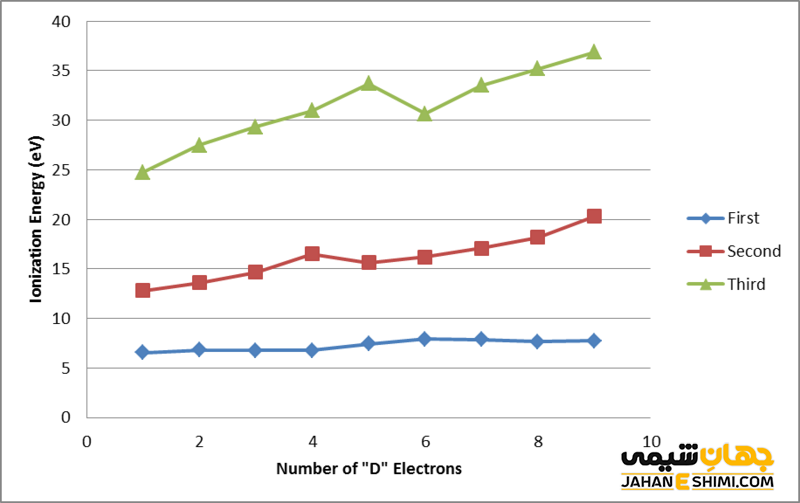
تصویر بالا تفاوت بین انرژی های یونیزاسیون اول، دوم و سوم را نشان می دهد. این تفاوت به این دلیل رخ می دهد که حذف الکترون ها با افزایش بار مثبت دشوار می شود. علاوه بر این، هنگامی که الکترون ها حذف می شوند، شعاع اتمی کاهش می یابد و حذف الکترون دیگر را دشوار می کند.
مقایسه انرژی دومین یونش
انرژی نخستین یونش، مقدار انرژی مورد نیاز یک اتم خنثی گازی برای حذف بیرونی ترین الکترون آن است. در حالی که انرژی یونیزاسیون دوم مقدار انرژی مورد نیاز یک اتم گازی با بار مثبت برای حذف بیرونی ترین الکترون است. میزان انرژی یونیزاسیون اول نسبت به انرژی یونیزاسیون دوم بسیار کمتر است.
اولین انرژی یونیزاسیون در رابطه با یک اتم با بار خنثی تعریف می شود. در حالی که انرژی یونیزاسیون دوم در مورد یک اتم با بار مثبت تعریف می شود. محصول نهایی انرژی یونیزاسیون اول یک اتم با بار مثبت یک است. در حالی که محصول انرژی یونیزاسیون دوم یک اتم با بار مثبت دو است.
اهمیت انرژی یونیزاسیون
انرژی یونیزاسیون نشان می دهد که حذف یک الکترون از اتم چقدر دشوار است؛ بنابراین یک پیش بینی کننده مفید برای واکنش پذیری و قدرت پیوندهای شیمیایی اتم است. هر چه انرژی یونیزاسیون بیشتر باشد، حذف الکترون سخت تر است. در نتیجه اتم هایی با انرژی یونیزاسیون پایین (مانند فلزات قلیایی) تمایل به واکنش پذیری بالایی دارند و به راحتی پیوندهای شیمیایی تشکیل می دهند. اتم هایی با انرژی یونیزاسیون بالا (مانند گازهای نجیب) واکنش پذیری پایینی از خود نشان می دهند و احتمال تشکیل پیوندها و ترکیبات شیمیایی کمتر است.
هلیوم عنصری است که بیشترین انرژی یونیزاسیون را دارد و در سمت راست بالای جدول تناوبی قرار دارد. فرانسیم، یک فلز قلیایی است که در سمت چپ پایین جدول قرار دارد و یکی از کمترین انرژی های یونیزاسیون را دارد.
عوامل موثر بر انرژی نخستین یونش
انرژی نخستین یونش یک عنصر به عوامل مختلفی از اتم بستگی دارد. عوامل موثر بر انرژی یونیزاسیون عبارتند از:
اندازه اتم
انرژی یونیزاسیون با اندازه اتم نسبت معکوس دارد. اگر اندازه اتم کوچک باشد، نیروی جاذبه هسته به سمت بیرونی ترین الکترون افزایش می یابد بنابراین انرژی یونیزاسیون افزایش می یابد.
بار هسته ای اتم
اگر عوامل دیگر بدون تغییر باقی بمانند، انرژی یونیزاسیون با بار هسته ای اتم نسبت مستقیم دارد. با افزایش بار هسته ای اتم، نیروی جاذبه بین هسته و اکثر الکترون های بیرونی افزایش می یابد و در نتیجه انرژی نخستین یونش نیز افزایش می یابد.
اثر غربالگری یا محافظت اوربیتال داخلی
اوربیتال داخلی با الکترون کامل به عنوان صفحه ای بین هسته و پوسته الکترونیکی بیرونی اتم عمل می کند. در نتیجه نیروی جاذبه هسته به بیرونی ترین پوسته کمتر است، یعنی بار هسته ای موثر هسته کمتر از مقدار بار واقعی آن است و مقدار انرژی یونیزاسیون کمتر از مقدار مورد انتظار است. قدرت یا تمایل لایه داخلی پر از الکترون بار هسته ای را اثر غربالگری می نامند.
قدرت نفوذ اوربیتال
مشخص شده است که اوربیتال های مختلف به دلیل شکل متفاوتشان قدرت نفوذ متفاوتی از خود نشان می دهند. به عنوان مثال، اوربیتال s نسبت به اوربیتال p و d بیشتر به سمت هسته نفوذ می کند. در نتیجه اوربیتال یا الکترون s بیشتر توسط بار هسته ای جذب می شود و اوربیتال f کمترین جذب توسط هسته را دارد. ترتیب انرژی یونیزاسیون اوربیتال های مختلف به صورت s>p>d>f است.
اثر اوربیتال نیمه پر یا پر شده
طبق اصل آفبا (Aufbau)، جدا کردن الکترون از اوربیتال نیمه پر یا پر بسیار دشوار است. در نتیجه انرژی نخستین یونش بسیار بالا است.
اثر پیکربندی الکترونیکی پوسته خارجی
اتم با پیکربندی الکترونیکی هشت تایی پایدارتر و بی اثرتر است؛ بنابراین انرژی لازم برای حذف یک الکترون از این نوع اتم بسیار بیشتر از اتم های دیگر خواهد بود. در نتیجه مقدار انرژی یونیزاسیون برای چنین نوع اتمی بیشتر از سایر اتم ها است.
کاربرد انرژی نخستین یونش
بسیاری از خواص مهم عنصر از مقدار انرژی یونیزاسیون آن مشخص می شود. به عنوان مثال، خواص فلزی و غیرفلزی عناصر را می توان از مقادیر انرژی نخستین یونش مشخص کرد. اگر مقدار انرژی یونیزاسیون اتم کم باشد، عنصر فلز و اگر زیاد باشد، عنصر غیرفلز خواهد بود. همچنین تعداد الکترون های ظرفیت موجود در اتم یک عنصر را می توان از روی مقدار انرژی یونیزاسیون تعیین کرد. به عنوان مثال، مقدار انرژی یونیزاسیون اول و دوم عنصر لیتیوم به ترتیب ۵.۴ eV و ۷۵.۶ eV است. این مقادیر نشان می دهد که اولین الکترون عنصر لیتیوم به راحتی آزاد می شود.
فعالیت شیمیایی عناصر را می توان با کمک مقدار انرژی یونیزاسیون آنها توضیح داد. هنگامی که انرژی نخستین یونش یک عنصر کم باشد، عنصر به یک فلز بسیار فعال تبدیل می شود. اما اگر مقدار انرژی یونیزاسیون یک عنصر خیلی زیاد باشد، عنصر غیرفعال می شود. اگرچه، این قانون فقط برای اتم های فلزی قابل اجرا است.
مقدار انرژی یونیزاسیون را می توان برای توضیح قدرت کاهنده یک عنصر نیز استفاده کرد. اگر مقدار این انرژی برای یک عنصر کم باشد، عنصر خاصیت کاهشی از خود نشان می دهد. همچنین می توان خواص قلیایی بودن عناصر را از مقدار انرژی یونیزاسیون آنها مشخص کرد. هنگامی که انرژی نخستین یونش یک عنصر کم باشد، عنصر یک فلز بسیار فعال با ماهیت قلیایی است.



















