
در علم شیمی، مول (Mole) به واحد اندازه گیری مقدار ماده در سیستم SI گفته می شود. در واقع یک مول مقداری از هر ماده شیمیایی محسوب می شود که تعداد ذرات بنیادی آن ماده (مولکول، اتم، یون و یا الکترون) برابر با تعداد اتم های موجود در ۱۲ گرم از کربن- ۱۲ باشد.

توجه داشته باشید که این تعداد، به یاد شیمیدان مشهور ایتالیایی یعنی آمدئو آووگادرو، عدد آووگادرو نامیده شده است که برابر با ۱۰۲۳ × ۶.۰۲۲۱۴۰۷۶ می باشد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی مول پرداخته می شود. لطفا با ما همراه باشید.
تعریف مول شیمی دهم
همانطور که بیان شد، مول یکی از واحد های شمارشی محسوب می شود. این واحد در حقیقت پیمانه ای است که با آن می توان تعداد ذرات ریزی مانند اتم ها یا مولکول ها را اندازه گیری کرد. به بیان دیگر، مقداری از یک ماده شیمیایی که تعداد واحد های بنیادی آن ماده با عدد آووگادرو برابر باشد، یک مول خواهد بود. همانگونه که هر دست لیوان، برابر با شش عدد لیوان است، پس یک Mole از هر چیزی نیز بیانگر ۱۰۲۳ × ۶.۰۲۲ از همان چیز است. بنابراین می توان گفت که یک مول اتم یا مولکول برابر با ۱۰۲۳ × ۶.۰۲۲ ذره می باشد.

در واقع شیمیست ها برای بیان تعداد اتم ها یا مولکول ها از کلمه مول استفاده می کنند. به عنوان نمونه، اگر ۵ Mole اکسیژن داشته باشید، یعنی ۵ برابر عدد آووگادرو، ملکول های اکسیژن دارید. به طور مشابه، اگر ۲ Mole اتم پتاسیم داشته باشید ۲ × (۱۰۲۳ × ۶.۰۲۲) اتم پتاسیم دارید. در صورتیکه در ۰/۵ Mole از مولکول بنزن، تعداد مولکول های بنزن برابر با ۰.۵ × (۱۰۲۳ × ۶.۰۲۲) خواهند بود. به عبارت دیگر، شیمیدانان جرم یک مول از اتم های یک ماده شیمیایی را اتم گرم می نامند، پس آنرا بر حسب گرم بیان می کنند. در حالیکه جرم یک مول از مولکول های یک ماده شیمیایی را مولکول گرم می گویند که بر اساس اتم گرم اتم های سازنده آن ماده شیمیایی به سادگی قابل محاسبه می باشد.

در واقع دانشمندان به دلیل سخت بودن یا غیر ممکن بودن کار با واحد amu در آزمایشگاه، به فکر ابداع این واحد افتادند. همچنین نوشتن کلمه Mole به جای نوشتن ۱۰۲۳ × ۶.۰۲۲ بسیار ساده تر می باشد، مخصوصا زمانیکه به طور همزمان به تعداد زیادی از موارد بخواهید اشاره کنید. به عبارت دیگر، این واحد، کار محاسبات را بسیار ساده نموده است. فرض کنید قرار باشد از فرمول ها و اعداد پیچیده جهت شمارش اتم ها استفاده کنید، در این صورت قطعا فرمول ها و محاسبه ها بسیار سخت خواهند بود.
از این واحد به طور گسترده می توان به عنوان روشی مناسب جهت بیان مقادیر واکنش دهنده ها، فرآورده ها و نسبت های موادی که در معادله شیمیایی شرکت کرده اند استفاده نمود. در واقع استوکیومتری، به موازنه و محاسباتی گفته می شود که با نسبت مقادیر مواد شیمیایی و عناصر در ترکیبات موجود در معادلات شیمیایی سرو کار دارد. به عنوان نمونه واکنش شیمیایی تولید آب را در نظر بگیرید :
۲H۲+O۲→۲H۲O
بر طبق معادله بالا مشخص می شود که دو Mole از مولکول هیدروژن با یک Mole از مولکول اکسیژن واکنش می دهند تا در نهایت دو Mole آب تولید شود. علاوه بر آن، غلظت یک محلول را به طور معمول به کمک مولاریته (مول بر لیتر) بیان می کنند که در واقع عبارتست از مقدار ماده حل شده در واحد حجم از محلول. همانطور که در بالا اشاره شد، این کمیت همچنین واحدی برای اندازه گیری مواد شیمیایی است، در حقیقت معادل عدد آووگادرو می باشد. لازم به ذکر است که در گذشته از عبارات گرم مولکول (g molecule) و گرم اتم (g atom) به ترتیب برای بیان تعداد مول مولکول ها و تعداد مول اتم ها استفاده می شد.

ارتباط میان تعداد اتم و مولکول
از آنجایی که یک مولکول اکسیژن شامل دو اتم اکسیژن است، در نتیجه، یک مول از O۲ حاوی دو مول اتم اکسیژن (O) خواهد بود. به کمک این مثال ساده می توان تعداد مولهای مولکول ها را به سادگی به تعداد مول اتم ها مرتبط کنید. مثلا مولکول اتانول را در نظر بگیرید. ۱ مولکول اتانول (C۲H۶O) شامل ۲ اتم کربن، ۶ اتم هیدروژن و ۱ اتم اکسیژن می باشد، از این رو ۱ مول اتانول (C۲H۶O) شامل ۲ مول کربن، ۶ مول هیدروژن و ۱ مول اکسیژن خواهد بود.

تاریخچه روز مول
روز مول توسط یک معلم شیمی اهل آمریکا به نام پروفسور موریس اوهلر پیشنهاد شده است. اوهلر پیشنهاد کرد که عدد آووگادرو که برابر با ۶/۰۲ ضرب در ۱۰ به توان ۲۳ را متناظر با نحوه نمایش زمان و تاریخ آمریکایی (ماه روز ساعت) در نظر بگیرند. بنابراین ۲۳ اکتبر هر سال توسط شیمیدانان، دانشجویان، محققان و علاقه مندان به شیمی در هفته شیمی (یعنی ۲۲ تا ۲۸ اکتبر) به عنوان روز مول گرامی داشته می شود.
چه مفاهیمی با مول همراه است؟
به کمک مفهوم مول و با استفاده از ضرایب تبدیل، می توان تعداد ذرات و مول ها را به یکدیگر تبدیل کرد. مثلا در تعداد ۱۰۲۴ × ۴.۷۲ اتم کربن، چند Mole کربن خواهد بود ؟
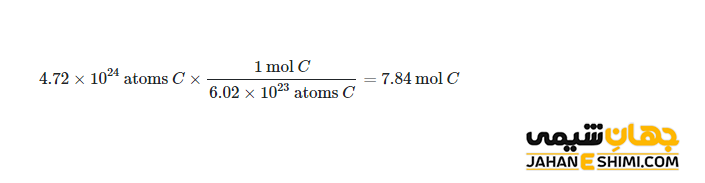
یکی از شایع ترین محاسبات در شیمی، تبدیل مول به گرم می باشد. مثلا محاسبه کنید که در ۲۴ گرم از کربن، چند مول کربن وجود دارد ؟ در واقع مشخص است که در ۲۴ گرم کربن به تعداد ۲ Mole کربن وجود دارد (۲۴ g / 12 g = 2 mole). یک تعریف دیگر برای این واحد وجود دارد که عبارت است از : یک مول مساوی با حجمی برابر با ۴/۲۲ لیتر یا ۲۲۴۰۰ میلی لیتر از یک ماده در حالت گاز در شرایط استاندارد می باشد. بنابراین می توان گفت که یک مول = جرم مولی بر حسب گرم = ۴/۲۲ لیتر یا ۲۲۴۰۰ میلی لیتر گاز در شرایط استاندارد = تعداد ۱۰۲۳ × ۶.۰۲۲ ذره از هر ماده است.

بین این واحد و کمیت های شیمی روابطی وجود دارد که در جدول زیر آورده شده است.
| بر مبنای عدد آووگادرو | ۱ mol A = 6.022 × ۱۰۲۳ A |
| بر مبنای جرم مولی | ۱ mol A = M.Wg A |
| بر مبناي شرايط استاندارد دما و فشار (STP) | ۱ mol A (g) = 22/4 L A (g) |
| بر مبناي ضريب های استوكيومتری در واكنش | mol A = mol B |
| بر مبناي غلظت محلول ها | mol A = 1 L A (aq) |
| بر مبناي مفهوم درصد خلوص | g A = 100 g A |
| بر مبناي مفهوم بازده درصدی | g A = 100 g A |
| بر مبنای مفهوم گرمای واکنش (آنتالپی) | mol = kJ |
علاوه بر آن، مفاهیمی همچون جرم مولی، غلظت مولی و کسر مولی نیز وجود دارند که برای درک آنها باید با مفهوم مول آشنا باشید. در ادامه مقاله به بررسی این مفاهیم می پردازیم.
جرم مولی
این واحد را می توان جزء خواص مشخص یک ماده شیمیایی به حساب آورد. برای محاسبه آن کافیست، جرم ماده شیمیایی مورد نظر را بر مقدار نمونه که به واحد مول تبدیل شده است، تقسیم کرد. در واقع، جرم مولی برابر با جرم ماده مورد بررسی بر حسب گرم به ازای یک مولی از آن ماده است. توجه داشته باشید که ماده مورد نظر می تواند به شکل های اتم، مولکول و یا یون باشد. به بیان دیگر به جرم یک مول ذره (اتم، مولکول یا یون) بر حسب گرم، جرم مولی (واحد آن g/mol) آن ذره گفته می شود. برای محاسبه این واحد در یک ماده شیمیایی، باید جرم مولی اتم های سازنده آن ماده را جمع کرد. به عنوان نمونه، جرم مولی مولکول آب (H۲O) برابر با ۱۸ = ۱۶+ (۱ × ۲) گرم بر مول می باشد.
به عبارت دیگر با داشتن جرم نمونه و جرم مولی، می توان به سادگی تعداد مولهای آن ماده را بدست آورد. این واحد به عوامل مختلفی همانند ترکیب و فرمول ملکولی آن ماده بستگی دارد. مثلا، یک عنصر که دارای دو نوع ایزوتوپ مختلف باشد، هر یک از آنها جرم مولی متفاوت دارد. در بیشتر موارد، مقدار عددی این واحد با جرم میانگین یک مولکول بر حسب دالتون برابر است.

غلظت مولی
این کمیت برای بیان غلظت محلول کاربرد دارد و با تعداد مولهای حل شونده در یک لیتر محلول تعریف می شود. نام دیگر آن، مولاریته یا غلظت مولار می باشد. مولاریته در سیستم SI با واحد های مول بر متر مکعب (mol/m۳) و مول بر دسی متر مکعب (mol/dm۳) تعریف می شود، در حالیکه معمولا در عمل از واحد مول بر لیتر (mol/L) برای گزارش مقدار آن استفاده می کنند.
کسر مولی
کسر مولی یا جزء مولی یک روش دیگر برای بیان غلظت می باشد که برای تعیین عناصر متفاوت موجود در یک ترکیب و یا غلظت یک ترکیب مورد نظر در یک مخلوط کاربرد دارد. در واقع به تعداد مولهای ترکیب در یک نمونه، تقسیم بر تعداد کل مول های اجزا آن مخلوط گفته می شود.

مول در شیمی یعنی چه
مول به عنوان اندازه گیری مقدار ماده تعریف می شود. مول پایه استوکیومتری است و به عنوان جرم ماده ای که از همان تعداد واحدهای اساسی تشکیل شده است تعریف می شود. بسته به ماده، واحدهای اساسی ممکن است مولکول ها، اتم ها یا واحدهای فرمول باشند. تعداد مول های یک ماده برابر است با نسبت جرم داده شده آن در یک واکنش شیمیایی به جرم یک مول از آن ماده. یک مول از هر ماده برابر با عدد آووگادرو است، یعنی ۶.۰۲۳ × ۱۰۲۳. همچنین برای بیان واحدهای غلظت مانند مول در لیتر یا وزن مولکولی استفاده می شود.
مفهوم مول برای اندازه گیری محصولات در هر واکنش شیمیایی بسیار مفید است. استفاده از مفهوم مول ضروری است زیرا الگوی سنتی توضیح یک واحد در سطح مولکولی کار نمی کند. به عنوان مثال، اندازه گیری یک مولکول همچنین به معنای اندازه گیری مقدار بالای اتم های موجود در مولکول است. اینجاست که مفهوم مول مطرح می شود. از آنجایی که مقدار ۱ مول برابر با ۶.۰۲۳ × ۱۰۲۳ اتم است، می توان گفت که یک مول یک واحد بزرگ است. یک مول برابر با عدد آووگادرو است.
تعداد مول های یک ماده برابر است با نسبت جرم داده شده آن در هر نوع واکنش شیمیایی به جرم یک مول از آن ماده. می توان آن را به عنوان تعداد مول های ممکن برای آن جرم معین از ماده تفسیر کرد. با علامت n نشان داده می شود و واحد اندازه گیری آن مول است. جرم یک مول از یک ماده برابر با جرم مولکولی آن است که با یافتن تعداد اتم های هر عنصر موجود در ترکیب و سپس ضرب وزن اتمی هر عنصر با آن محاسبه می شود.
مفهوم مول پایه استوکیومتری است. هنگام بیان واکنش دهنده ها و محصولات در یک واکنش شیمیایی، از مفهوم مول برای بیان مقدار واکنش دهنده ها و محصولات استفاده می شود. بنابراین، تمام واکنش های شیمیایی را می توان بر حسب مول نشان داد.
یک مول چند گرم است شیمی دهم
مول یکی از کلماتی که در شیمی بسیار شنیده می شود یه همین دلیل باید با این مفهوم آشنا شوید. این واژه از لاتین گرفته شده و به معنی جرم یا توده است و در شیمی به مقدار خاصی از یک ماده اشاره دارد. در شیمی از مول برای اندازه گیری استفاده می شود و کمک می کند تعداد دقیق ذرات کوچک مانند اتم را محاسبه کنیم. در شیمی همچنین با جرم مولی سر و کار داریم و در استوکیومتری نیز از این کمیت زیاد استفاده می شود. علاوه بر شیمی در کنترل کیفی مواد غذایی، بیوشیمی، زیست شناسی و داروسازی نیز از مول استفاده می شود. لازم به ذکر است که هر مول برابر است با ۱۰۲۳×۶٫۰۲۲ عدد از هر چیزی که به آن عدد آووگادرو می گویند و جرم یک مول هر ماده ای برابر است با جرم مولی آن ماده است مثلا ۱ مول هیدروژن برابر با ۱ گرم است یا یک مول آب ۱۸ گرم است.



















