
در علم شیمی ایزومر یا همپار (Isomers) به ترکیباتی گفته می شود که علی رغم داشتن فرمول شیمیایی یکسان و مشابه، فرمول ساختاری متفاوتی از خود نشان دهند. به عبارت دیگر ترکیباتی که فرمول های بسته یکسانی دارند، در حالیکه فرمول های گسترده آنها متفاوت است. در واقع در ایزومر ها، آرایش اتمی دو ترکیب، متفاوت می باشد. این دسته از ترکیبات در خواص شیمیایی و فیزیکی با یکدیگر فرق دارند. تنها در صورتیکه دارای گروه های عاملی مشابه باشند، خواص شیمیایی مشابه نیز خواهند داشت. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی ایزومر و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
تعریف ایزومر شیمی یازدهم
کلمه ایزومر نخستین بار توسط شیمیدان سوئدی برزلیوس (J.J.Berzelius) جهت معرفی ترکیبات شیمیایی گوناگون که ترکیب درصد عناصر آنها یکسان بوده است استفاده شد. این واژه در حقیقت از کلمات یونانی isos و meros به معنای ساخته شده از بخش های یکسان، گرفته شده است.

همانطور که بیان شد ترکیبات همپار، به دو یا چند ترکیب که از اتم های یکسان و با نسبت های یکسان (تعداد اتم یکسان از هر عنصر) تشکیل شده اند گفته می شود. لازم به ذکر است که ترتیب یا نحوه قرار گرفتن این اتم ها در هر یک از ایزومرها متفاوت خواهد بود. به عنوان نمونه دو مولکول بوتان و متیل پروپان را در نظر بگیرید. این دو مولکول فقط از اتم های کربن و هیدروژن تشکیل شده اند و دارای فرمول مولکولی C۴H۱۰ می باشند. در ساختار بوتان، چهار اتم کربن پشت سر هم و به شکل زنجیره ای قرار گرفته اند، در حالیکه در ساختار متیل پروپان، مولکولی شاخه شاخه را می سازند. در واقع در هر زنجیره متیل پروپان تنها ۳ اتم کربن وجود دارد. بنابراین مولکول های بوتان و متیل پروپان ایزومرهای یکدیگر هستند.
توجه داشته باشید که خواص فیزیکی و شیمیایی همپار ها می تواند متفاوت باشد. مثلا دو ترکیب ذکر شده (بوتان و متیل پروپان)، هر دو گازهایی بی رنگ اند، درحالیکه نقطه جوش متفاوتی را نشان می دهند. اندازه گیری ها نشان می دهد که نقطه جوش بوتان (۰.۵- درجه سانتیگراد)، بیشتر از نقطه جوش متیل پروپان (۱۲- درجه سانتی گراد) می باشد.
انواع ایزومری
در حالت کلی، می توان ایزومری ها را به دو نوع اصلی ایزومری ساختمانی (Structural Isomers) و ایزومری فضایی (Stereo Isomers) تقسیم بندی نمود. توجه داشته باشید که هر کدام از این دسته ها خود دارای انواع مختلفی می باشند.
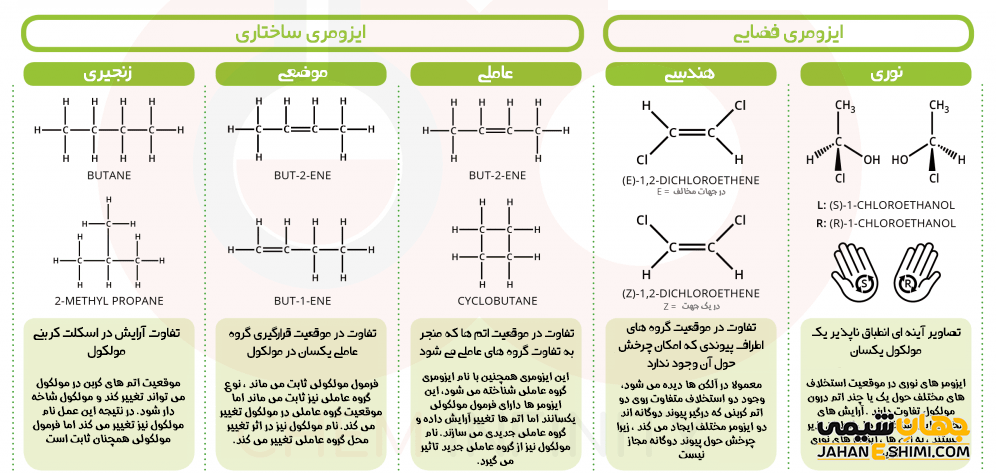
ایزومر های ساختمانی یا ساختاری
همپار های ساختاری، فرمول مولکولی یکسانی دارند، در حالیکه ساختار های متفاوتی را نشان می دهند. در واقع در این نوع از ایزومری، اتم ها یا گروه های عاملی می توانند به شکل های متفاوتی به یکدیگر وصل شوند. این نوع از ایزومری به سه گروه زیر تقسیم می شود. در ادامه مقاله به بررسی این همپار ها می پردازیم.
- ایزومر اسکلتی یا شاخه ای
- ایزومر موضعی
- ایزومر عاملی
ایزومر های اسکلتی یا شاخه ای
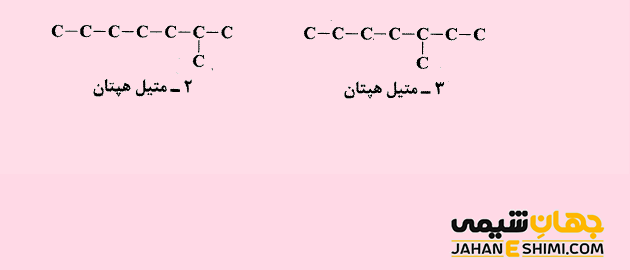
در ایزومر های اسکلتی یا شاخه ای (chain isomerism or skeletal isomerism)، مولکول ها فرمول مولکولی یکسان، اما اسکلت کربنی متفاوتی دارند. برخی ترکیبات آلی بر پایه زنجیر هایی راست و بدون شاخه از اتم های کربن تشکیل شده اند. برخی دیگر از آنها دارای زنجیری از اتم های کربن می باشند که اطراف آن چندین شاخه فرعی وجود دارد. لازم به ذکر است که تعداد ایزومر ها با زیاد شدن تعداد کربن ها، به سرعت افزایش می یابد، زیرا یک اسکلت کربنی به راحتی می تواند به چندین شکل مختلف شاخه دار شود. به عنوان مثال، مولکول های ۲- متیل هپتان و ۳- متیل هپتان را در نظر بگیرید. فرمول شیمیایی هر دو مولکول، یکسان است، اما از آن جهت که در محل قرارگیری گروه متیل با هم متفاوت اند، بنابراین مولکول های متفاوتی نیز خواهند بود.
ایزومر های موضعی یا موقعیتی
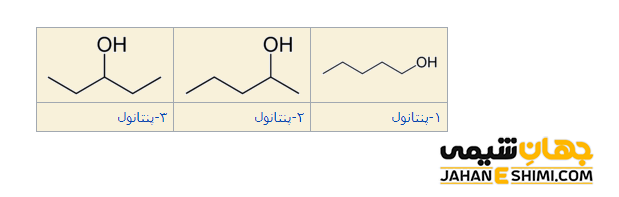
تفاوت ایزومر های موضعی (Position isomerism or regioisomerism)، به دلیل تغییر موقعیت گروه عاملی در مولکول می باشد. در شیمی آلی، گروه عاملی به قسمتی از مولکول گفته می شود که سبب واکنش پذیری مولکول است. توجه داشته باشید که انواع مختلف گروه عاملی وجود دارد. در این نوع ایزومری تنها موردی که تغییر می کند، در حقیقت مکان و موقعیت گروه عاملی خواهد بود. لازم به ذکر است که از روی نام مولکول می توان محل قرار گیری گروه عاملی را مشخص نمود. مثلا در آلکن ها، بسته به موقعیت پیوند دوگانه، چند ایزومر ساختاری ایجاد می گردد. مولکول های ۱- پنتانول و ۲- پنتانول نیز ایزومر های موضعی یکدیگرند.
ایزومر های عاملی یا گروه عاملی
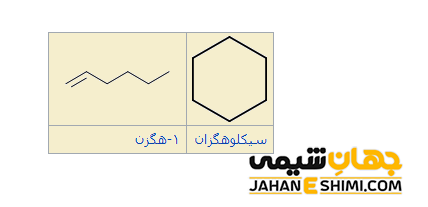
ایزومرهای گروه عاملی (Functional group isomerism) نیز فرمول مولکولی یکسانی دارند، اما گروه عاملی موجود در آنها متفاوت می باشد. مثلا یک آلکن راست زنجیر با سیکلو آلکان مربوطه (در آن،کربن ها به شکلی به یکدیگر متصل اند که حلقه تشکیل می شود) ایزومر عاملی خواهد بود. یا اینکه الکل C۲H۵OH با اتر CH۳OCH۳ ایزومر گروه عاملی یکدیگر محسوب می شوند.
ایزومری فضایی
ایزومر فضایی یا استرئو ایزومر، نوع خاصی از ایزومری می باشد که در آن شکل پیوند میان اتم ها یکسان است، اما در حقیقت شکل هندسی اتم ها یا گروه های عاملی در فضا متفاوت می باشد. در واقع در این مدل از مولکول ها، همپار ها تفاوت ساختاری زیادی با هم ندارند. تنها اختلاف آنها با یکدیگر، در نحوه قرار گرفتن اتم هایشان در فضا است. این نوع از همپارها به دو گروه زیر تقسیم می شود. در ادامه مقاله به بررسی این نوع از ایزومرها می پردازیم.
- ایزومر هندسی یا شکلی
- ایزومر نوری
ایزومر هندسی یا شکلی
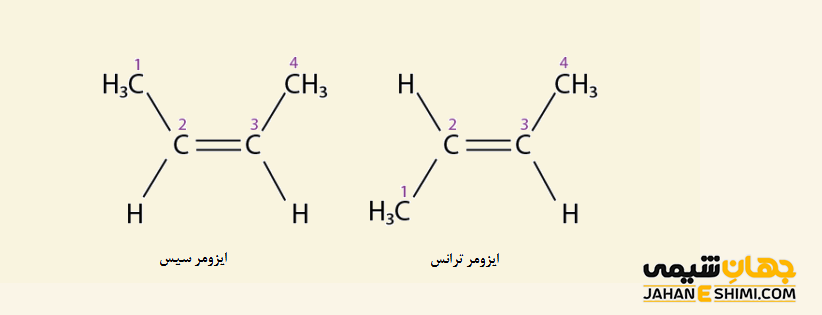
همپار های هندسی (Geometric Isomers) به همپار هایی گفته می شود که مرتبه پیوند در آنها برابر است اما نوع آرایش اتم ها در اطراف پیوند با یکدیگر تفاوت داشته باشد. این نوع از ایزومری، معمولا در ترکیباتی مشاهده می شود که دارای پیوند دوگانه کربن – کربن باشند. همانطور که می دانید، چرخش حول پیوند دوگانه بر خلاف پیوند های یگانه که امکان چرخش آزاد حول محور پیوند وجود دارد، امکان پذیر نیست. بنابراین در آلکن ها، زمانیکه گروه های مشابه و یکسان در یک طرف پیوند دوگانه قرار گرفته باشند، ایزومر سیس (cis) و زمانیکه در دو طرف پیوند دوگانه قرار بگیرند، ایزومر ترانس (trans) دارید.
به عنوان مثال مولکول ۲-بوتن را در نظر بگیرید. همانگونه که بیان شد، دو شکل مختلف را برای مولکول ۲-بوتن می توان متصور شد. این دو حالت متفاوت سیس و ترانس در شکل زیر آورده شده است. همانطور که مشاهده می کنید، در ایزومر سیس، پیوند های یگانه هیدروژن- کربن، در یک سمت مولکول قرار گرفته اند، در حالیکه، در ایزومر ترانس، این پیوندها در دو طرف مولکول قرار دارند.
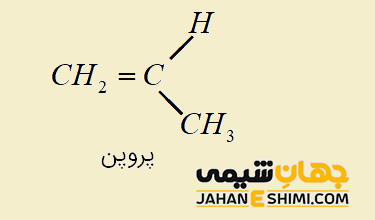
حال اگر دو گروه متصل به یک کربن آلکن مشابه باشند، ایزومری سیس و ترانس وجود ندارد. به عنوان مثال، مولکول پروپن (تصویر زیر)، هیچ ایزومر هندسی نخواهد داشت. زیرا در مولکول فوق یکی از اتم های کربن در پیوند دوگانه، (اتم کربن سمت چپ) دارای دو گروه متصل یکسان (اتم های هیدروژن) می باشد. لازم به ذکر است که در آلکین ها نیز به دلیل اینکه تنها یک گروه، به پیوند سه گانه متصل است، پس ایزومر هندسی نخواهیم داشت.
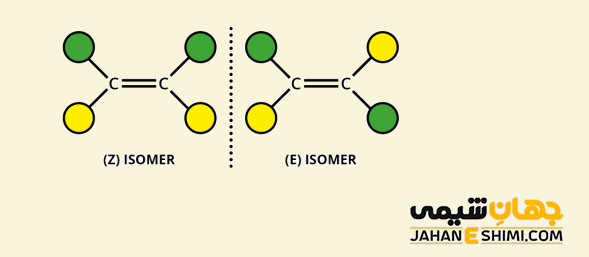
در آلکن ها، اگر یک اتم هیدروژن و سه اتم متفاوت دیگر بر روی اتم های کربن درگیر در پیوند دوگانه داشته باشید، به جای واژه های سیس و ترانس از سیستم Z و E استفاده می شود. حرف E از واژه آلمانی Entgegen به معنای مخالف و حرف Z از کلمه آلمانی Zusammen به معنای هم جهت گرفته شده است. از این رو، اگر گروه یا اتم های سنگین بر روی اتم های کربن در یک سمت مولکول و اتم های سبکتر در طرف دیگر مولکول قرار گیرند، مولکول Z خواهد بود. درصورتی که این گروه ها در جهات مقابل هم قرار داشته باشند، مولکول E می باشد.
توجه داشته باشید که مشخص کردن گروه های سنگین تر به عدد اتمی عنصر متصل به کربن وابسته است. در واقع هر چه عدد اتمی عنصر متصل به کربن بیشتر باشد، گروه سنگین تر محسوب شده و ارجحیت بیشتری خواهد داشت. از طرفی دیگر، توجه کنید که خواص فیزیکی و شیمیایی ایزومر های هندسی نیز با یکدیگر متفاوت است.
ایزومر نوری
ایزومر نوری (Optical Isomer) به بقیه همپار های فضایی که به شکل همپار هندسی نباشند، گفته می شود. نام این دسته از ترکیبات، به دلیل برهمکنش مولکول با نور پلاریزه به آنها داده شده است. این دسته از همپارها، در محل قرار گیری اتم یا گروه های استخلافی اطراف اتم های یک مولکول با هم تفاوت دارند. ایزومرهای نوری به طور کلی به دو دسته انانتیومر ها (Enantiomers) و دیاسترومر ها (Diastereomers) تقسیم می شوند.
انانتیومر ها
انانتیومر (Enantiomer) یا تصویر آینه ای به مولکول هایی گفته می شود که بر تصویر آینه ای خود منطبق نباشند. توجه داشته باشید که انانتیومر ها می توانند قرینه یکدیگر باشند. این نوع از ایزومری در مولکول های کایرال (Chiral) دیده می شود. به بیان دیگر، کایرالیته شرط لازم و کافی برای وجود انانتیومرها می باشد. در واقع به ترکیباتی که تصویر آینه ای آنها بر هم منطبق نباشند کایرال می گویند. در هنگام بررسی یک مولکول، اگر اتم کربن به چهار گروه مختلف متصل شده باشد، کایرال در نظر گرفته می شود.

دو ترکیب که از هر نظر با هم مشابه باشند، قطعا بر یکدیگر منطبق می شوند. حال یک مولکول کایرال می تواند دارای یک ایزومر فضایی باشد که بر تصویر آینه ای خود منطبق نیست. به این مولکول ها انانتیومر گفته می شود. اختلاف چنین ایزومرهایی همانند اختلاف میان دست چپ و راست خواهد بود. به چنین مولکول هایی نا متقارن یا پاد متقارن نیز می گویند.
این نوع از ترکیبات دارای خواص فیزیکی یکسانی هستند و تنها تفاوت همپار های نوری در تاثیر آنها بر نور قطبی شده (نوری که در یک صفحه نوسان می کند) است. در واقع با استفاده از همین تفاوت و استفاده از دستگاه خاص مربوطه می توان این دو همپار را از یکدیگر تشخیص داد.به طور کلی انانتیومر ها به دو نوع تقسیم می شوند. انانتیومر راست گردان (d) که نور قطبی شده را به سمت راست و انانتیومر چپ گردان (L) که آن را به سمت چپ می چرخانند. حال اگر یک نمونه شامل غلظت های برابر از هر دو انانتیومر راست گرد و چپ گرد باشد، در این صورت چرخش خالصی در صفحه نور قطبیده در هنگام عبور نور از نمونه رخ نمی دهد. در حقیقت نمونه از لحاظ نوری غیر فعال بوده و تاثیری بر نور قطبی شده ندارد. این مخلوط را راسمیک می نامند.
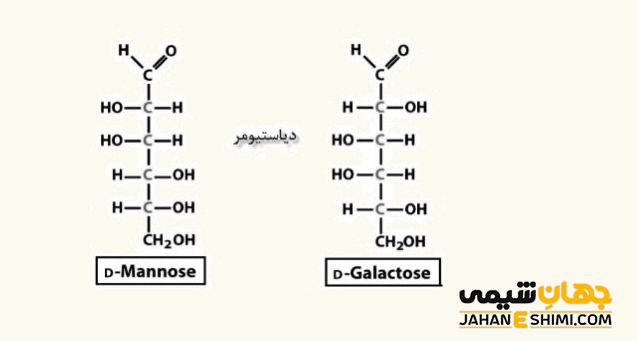
دیاسترومر ها
دیاسترومر ها (Diastereomers) یا میان فضاپار در حقیقت به گروهی از ایزومر های فضایی که انانتیومر یکدیگر نباشند گفته می شود. در واقع شرط لازم برای دیاسترومر بودن آنست که این ترکیبات، تصویر آینه ای یکدیگر نیز نباشند.
برخلاف انانتیومر ها، دیاسترئومر ها از لحاظ خواص شیمیایی و فیزیکی با یکدیگر فرق دارند. البته از آنجاییکه دیاسترئومر ها به طور کلی از یک خانواده می باشند، پس دارای خواص شیمیایی مشابهی خواهند بود. با توجه به اختلاف خواص فیزیکی، می توان آنها را با کمک روش های مختلفی نظیر اختلاف نقطه جوش (تقطیر جزء به جزء)، اختلاف نقطه ذوب (تبلور)، اختلاف حلالیت یا روش های کروماتوگرافی از یکدیگر جدا کرد. این ترکیبات از نظر ضریب شکست، چگالی، انحلال پذیری و قطبیت نیز باهم متفاوت می باشند.
کاربرد ایزومر ها
این ترکیبات (به ویژه انانتیومرها) در پزشکی، داروسازی و بیوشیمی اهمیت ویژه ای دارند. زیرا در واقع فعالیت های بیولوژیکی مختلفی را نشان می دهند. مثلا دارو هایی همچون ایبوپروفون ها و البوترول ها که برای بیماران آسمی کاربرد دارند. توجه داشته باشید که معمولا یکی از دو ایزومر انانتیومر خواص دارویی را نشان می دهد. به عنوان نمونه داروی سیس پلاتین که دارویی موثر در شیمی درمانی سرطان محسوب می شود، اما ایزومر ترانس آن (ترانس پلاتین)، هیچ نوع خاصیت دارویی یا پزشکی ندارد. به عبارت دیگر، ممکن است یکی از انانتیومرها یک غذای مقوی، یک آنتی بیوتیک موثر و یا یک داروی محرک قلب باشد، در حالیکه ایزومر دیگر آن یک ترکیب بی مصرف باشد.
خواص فیزیکی و شیمیایی ایزومر ها
ایزومرها فرمول مولکولی یکسانی دارند اما به دلیل آرایش ساختاری متفاوت، خواص متفاوتی دارند. ایزومرها ترکیباتی هستند که فرمول مولکولی یکسانی دارند، یعنی تعداد و نوع اتم های آنها یکسان است، اما در نحوه چیدمان این اتم ها با هم تفاوت دارند. این تفاوت در آرایش ساختاری منجر به خواص فیزیکی و شیمیایی متفاوتی می شود. مفهوم ایزومر یک جنبه اساسی از شیمی آلی است. دو نوع اصلی ایزومریسم وجود دارد: ایزومریسم ساختاری (یا ساختاری) و استریوایزومریسم. ایزومرهای ساختاری اتم هایشان به ترتیب متفاوتی به هم متصل هستند. به عنوان مثال، بوتان و ایزوبوتان ایزومرهای ساختاری هستند. هر دو فرمول C4H10 دارند، اما آرایش اتم های کربن متفاوت است. این تفاوت در ساختار منجر به نقاط جوش، نقاط ذوب و سایر خواص فیزیکی می شود.
از سوی دیگر، استریو ایزومرها اتصال یکسانی دارند اما آرایش متفاوتی از اتم ها در فضا دارند. این نوع ایزومر شامل ایزومرهای هندسی (همچنین به عنوان ایزومرهای سیس ترانس شناخته می شود) و ایزومرهای نوری است. ایزومرهای هندسی در ترکیباتی با چرخش محدود (مانند پیوندهای دوگانه یا ساختارهای حلقه) رخ میدهند، جایی که اتمها میتوانند موقعیتهای مختلفی را نسبت به یکدیگر اشغال کنند. ایزومرهای نوری تصاویر آینه ای از یکدیگر هستند، مانند دست چپ و راست. آنها می توانند نور پلاریزه شده صفحه را در جهات مختلف بچرخانند، از این رو “نوری” نامیده می شود.
آرایش ساختاری مختلف ایزومرها همچنین می تواند منجر به تفاوت در واکنش پذیری شیمیایی شود. به عنوان مثال، واکنش یک ترکیب آلی اغلب به گروه عاملی (مانند OH، COOH، NH2 و غیره) موجود در مولکول بستگی دارد. در ایزومرهای ساختاری، موقعیت گروه عاملی می تواند متفاوت باشد، که می تواند به طور قابل توجهی بر واکنش پذیری ترکیب تأثیر بگذارد. به طور خلاصه، ایزومرها فرمول مولکولی یکسانی دارند اما خواص متفاوتی دارند زیرا اتم های آنها به طور متفاوتی مرتب شده اند.



















